
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальні властивості металів.Содержание книги
Поиск на нашем сайте
1. Метали мають ряд загальних властивостей. Причиною однакових фізичних і хімічних властивостей металів є подібність будови їхніх атомів і природи кристалічних решіток металів. До загальних фізичних властивостей металів належать: висока електропровідність, висока теплопровідність, пластичність, металічний блиск, непрозорість. Пластичність – здатність деформуватися при звичайній і підвищеній температурі, не руйнуючись. Пластичність металів пояснюється специфічними властивостями металічного зв’язку. При механічному впливі на тверде тіло окремі шари його кристалічної решітки зміщуються відносно один одного. У кристалах з атомною структурою це призводить до розривання ковалентних зв’язків між атомами, що належать різним шарам, і кристал руйнується. У кристалах з йонною структурою при взаємному зміщенні шарів неминуче створюється таке положення, при якому поряд виявляються однойменно заряджені йони. При цьому виникають сили електростатичного відштовхування і кристал також руйнується. При зміщенні окремих шарів кристалічної решітки металу відбувається лише деякий перерозподіл електронного газу, що зв’язує атоми металу один з одним, але хімічні зв’язки не розриваються – метал деформується, не руйнуючись. Завдяки цій властивості метали можна кувати, прокатувати, витягувати в дріт, штампувати. Металічний блиск зумовлюється здатністю металів добре відбивати світло. Висока тепло- і електропровідність металів зумовлені можливістю вільного переміщення електронів зони провідності. З погляду хімії всі метали порівняно легко віддають валентні електрони і, як наслідок цього, здатні утворювати позитивно заряджені йони і виявляти у своїх сполуках тільки позитивну окислюваність. Металів у різних сполуках завжди мають позитивний ступінь окиснення. У зв’язку з цим метали у вільному стані є відновниками. Відновна здатність різних металів неоднакова. Для реакцій у водних розчинах вона визначається положенням металу в ряду напруг і концентрацією його йонів у розчині. 2. Кристалічну будову металів вивчають різними методами. Їх можна розділити на дві групи. До першої належать методи вивчення внутрішньої будови кристалів. До другої – методи вивчення їхніх зовнішніх форм. Внутрішню будову кристалів вивчають, головним чином, за допомогою рентгеноструктурного аналізу. За його даними для всіх металів установлено типи і параметри кристалічних граток. Кристалічні гратки металів можуть бути різних типів. Однак для більшості металів характерні три типи граток: · об’ємноцентрована кубічна (Li, Na, K, V, Cr, Fe(при температурах до 912ºС і від 1394ºС до плавлення), Pb, W) · гранецентрована кубічна (Al, Fe(від 912ºС до 1394ºС), Ca, Ni, Cu, Ag, Au) · гексагональна (Be, Mg, Cd, Ti, Co, Zn)
б) гранецентрована кубічна в) гексагональна
Розміри, форму і взаємне розміщення кристалів у металах вивчають металографічними методами. Найповнішу оцінку структури металу з цього погляду дає мікроскопічний аналіз його шліфу. З досліджуваного металу вирізають зразок і його площину шліфують, полірують і протравлюють спеціальним розчином (травником). В результаті травлення виявляється структура зразка, яку розглядають або фотографують за допомогою металографічного мікроскопа.
Схема різної орієнтації кристалічних решіток у полікристалічному тілі
Внутрішня структура зерна металу не є точно правильною. Металам властиві дефекти структури. 3. Сплав – суміш якого-небудь металу з одним або кількома іншими елементами.
1) У твердому стані метали, що сплавляються, не розчиняються один в одному і хімічно не взаємодіють один з одним. За цих умов сплав є хімічною сумішшю і складається з кристалітів одного і другого компонентів, які чітко видно на мікрошліфі.
3) У процесі кристалізації з розплаву розчинність металів один в одному зберігається. Утворюються однорідні кристали. У цьому випадку тверда фаза називається твердим розчином. При цьому для одних металів взаємна розчинність їх у твердому стані не обмежена, інші ж розчиняються один в одному лише до певних концентрацій.
Контрольні запитання:
Література:
Тема 5.2. Одержання металів План 1. Добування металів з руд. *
2.1. Перегонка у вакуумі. ** 2.2. Зонне плавлення. ** 2.3. Термічне розкладання летких сполук металів. ** 1. Переважна більшість металів у природі знаходиться у вигляді сполук з іншими елементами. Тільки небагато металів трапляються у вільному стані, і тоді їх називають самородними. Золото і платина трапляються майже винятково в самородному вигляді, а срібло і мідь – почасти; іноді трапляються також самородні ртуть і деякі інші метали. Золото і платину добувають або за допомогою механічного відокремлення їх від тієї породи, в якій вони містяться, або вилученням їх з породи різними реагентами з подальшим виділенням з розчину. Всі ж інші метали добувають хімічною переробкою їхніх природних сполук. Мінерали і гірські породи, що містять сполуки металів і придатні для добування цих металів заводським способом, називаються рудами. Найголовніші руди містять оксиди, сульфіди і карбонати металів. Пірометалургія охоплює способи отримання металів з руд за допомогою реакцій відновлення, що проводяться при високих температурах. В якості відновників використовують вугілля, активні метали, карбон (ІІ) оксид, водень, метан. В основі цього методи лежить реакція відновлення металу з його оксиду: Сu2O + C → 2Cu + CO. У тих випадках, коли руда є сульфідом металу, її попередньо переводять в оксид шляхом окислювального обпалення, а потім оксид металу відновлюють вугіллям: 2ZnS + 3O2 → 2ZnO + 2SO2 ZnO + C → Zn + CO Відновлення металів з їх сполук іншими металами, хімічно більш активними, при високих температурах називається металотермією. В якості відновників використовують алюміній (алюмінотермія), магній (магнійтермія), кальцій, натрій. Цим способом одержують ті метали, які при відновленні їх оксидів вугіллям утворють карбіди (Mn, Cr, Ti, Mo, W). Гідрометалургія охоплює способи отримання металів з розчину їх солей. При цьому метал, який входить до складу руди, спочатку переводять в розчин за допомогою необхідних реагентів, а потім виділяють його з цього розчину. Цим методом добувають до 25% міді, золото, срібло, цинк. Кадмій, молібден, уран. Електрометалургія охоплює способи отримання металів за допомогою електролізу. Цим способом одержують легкі метали з їх розплавлених оксидів або хлоридів: алюміній, натрій і т.д. 2. Протягом останніх десятиріч, у зв’язку з розвитком нових галузей техніки, виникла потреба в металах дуже високої чистоти. У зв’язку з потребами промисловості розроблено нові способи очищення речовин. 2.1. Перегонка у вакуумі. Цей спосіб ґрунтується на різниці в леткості металу, який очищається, і наявних у ньому домішок. Вихідний метал завантажують у спеціальну посудину, з’єднану з вакуум-насосом, після чого нижню частину посудини нагрівають. У процесі перегонки на холодних частинах посудини осідають або домішки (якщо леткість їх більша, ніж основного металу), або очищений метал (якщо домішки мають меншу леткість). Процес здійснюється при безперервному відкачуванні повітря, бо наявність навіть невеликої кількості кисню спричинила б окиснення поверхні розплавленого металу і тим самим загальмувала б процес випаровування. 2.2. Зонне плавлення полягає в повільному протягуванні бруска металу, який треба очистити, через кільцеву піч. Та ділянка (зона) бруска, яка перебуває в цей момент у печі, плавиться. В міру пересування бруска рідка зона переміщується від початку бруска до його кінця. Зонному плавленню підлягає метал, що пройшов попереднє очищення. Вміст домішок у ньому вже невеликий, так що основний метал і домішки утворюють гомогенний твердий розчин. Під час переміщення бруска через кільцеву піч відбувається плавлення металу біля передньої межі зони і кристалізація його біля задньої межі. При цьому склад кристалів, які утворилися і перебувають в рівновазі з розплавом, відрізняється від складу розплаву. Домішки одних металів концентруються в розплавленій зоні і переміщуються разом з нею до кінця бруска; домішки інших металів концентруються у кристалах, що утворилися, лишаються за рухомою зоною і при неодноразовому повторенні процесу переміщуються до початку бруска. Внаслідок цього середня частина бруска буде найчистішою; її вирізають і використовують. 2.3. Термічне розкладання летких сполук металу. Карбонільний процес. Цей спосіб застосовують для добування високо чистих нікелю і заліза. Метал, який треба очистити, нагрівають в атмосфері СО, що знаходиться під тиском близько 20 МПа. При цьому нікель взаємодіє з СО, утворюючи леткий тетракарбоніл нікелю Ni(CO)4; домішки, які є у вихідному металі, в таку реакцію не вступають. Добутий Ni(CO)4 відганяють, потім нагрівають до вищої температури. Внаслідок цього карбоніл руйнується з виділенням високо чистого металу. Йодидний спосіб. Дає змогу добувати титан, цирконій і деякі інші метали значної чистоти. Пр.: Титан у вигляді порошку нагрівають до 100-200ºС з великою кількістю йоду в герметичному апараті. В апараті натягнуто титанові нитки, які нагріваються електричним струмом до 1300-1500С. Титан утворює з йодом леткий йодид TiI4 , який розкладається на розжарених нитках. Чистий титан, що при цьому виділяється, осідає на них, а йод утворює з вихідним металом нові порції йодиду; процес відбувається безперервно до перенесення всього металу на титанові нитки. Контрольні запитання:
Література:
Тема 5.3. Магній і берилій. План
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.233.69 (0.007 с.) |

 а) об’ємноцентрована кубічна
а) об’ємноцентрована кубічна Кристали металів звичайно мають невеликі розміри. Тому будь-який металевий виріб складається з великої кількості кристалів. Така структура називається полікристалічною. При кристалізації металу з розплавленого стану кристали, що ростуть, заважають один одному набувати правильної форми. Тому кристали полікристалічного тіла мають неправильну форму і на відміну від правильно огранованих кристалів називаються кристалітами, або зернами. Зерна розрізняються між собою просторовою орієнтацією їхніх кристалічних решіток.
Кристали металів звичайно мають невеликі розміри. Тому будь-який металевий виріб складається з великої кількості кристалів. Така структура називається полікристалічною. При кристалізації металу з розплавленого стану кристали, що ростуть, заважають один одному набувати правильної форми. Тому кристали полікристалічного тіла мають неправильну форму і на відміну від правильно огранованих кристалів називаються кристалітами, або зернами. Зерна розрізняються між собою просторовою орієнтацією їхніх кристалічних решіток. При травленні шліфу межі зерен роз’їдаються більше; вони стають поглибленими. Світло, падаючи на них, розсіюється, і в полі зору мікроскопа межі зерен здаються темними, а самі зерна – світлими.
При травленні шліфу межі зерен роз’їдаються більше; вони стають поглибленими. Світло, падаючи на них, розсіюється, і в полі зору мікроскопа межі зерен здаються темними, а самі зерна – світлими.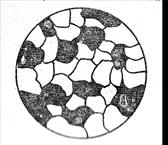 У рідкому стані більшість металів розчиняються один в одному і утворюють однорідний рідкий сплав. У процесі кристалізації з розплавленого стану різні метали поводять себе по-різному, що зумовлює існування таких трьох типів сплавів:
У рідкому стані більшість металів розчиняються один в одному і утворюють однорідний рідкий сплав. У процесі кристалізації з розплавленого стану різні метали поводять себе по-різному, що зумовлює існування таких трьох типів сплавів: 2) Метали, які сплавляються, взаємодіють один з одним, утворюючи хімічну сполуку.
2) Метали, які сплавляються, взаємодіють один з одним, утворюючи хімічну сполуку.


