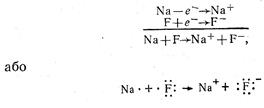Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поняття про хімічний зв'язок. Типи хімічного зв’язку.Содержание книги
Поиск на нашем сайте
1. Хімічний зв'язок – взаємодія атомів, яка приводить до утворення хімічно стійкої двох- або багатоатомної системи (молекули або кристалу). Природа хімічного зв’язку має електростатичний характер. Типи хімічного зв’язку
2. Ковалентний зв’язок – це зв'язок, що утворюється за рахунок спільних електронних пар. Природа ковалентного зв’язку визначається силою електростатичного притягання двох сусідніх ядер до пари електронів, розташованої між ними. Існує 2 погляди на розгляд механізму утворення хімічного зв’язку: - метод валентних зв’язків (МВЗ) - метод молекулярних орбіталей (ММО) МВЗ дав теоретичне пояснення найважливіших властивостей ковалентного зв’язку, дав змогу зрозуміти будову великої кількості молекул. В основі МВЗ лежать такі положення: 1. Ковалентний хімічний зв'язок утворюється 2 електронами з протилежно напрямленими спінами, причому ця електронна пара належить двом атомам. 2. Ковалентний зв'язок тим міцніший, чим більшою мірою перекриваються взаємодіючі електронні хмари. Перекривання можливе тільки при певній взаємній орієнтації електронних хмар; при цьому область перекривання розміщується в певному напрямі відносно взаємодіючих атомів. Тобто ковалентний зв'язок має певну напрямленість: σ - зв'язок (перекривання атомних хмар відбувається поблизу прямої, що сполучає ядра взаємодіючих атомів) π – зв’язок (перекривання атомних хмар відбувається з обох боків від прямої, що сполучає ядра взаємодіючих атомів). Найчастіше ковалентний зв'язок утворюється за обмінним механізмом. Сутність обмінного механізму полягає в тому, що кожний атом надає по 1 електрону для спільної електронної пари. Приклад: 1) Н2 H∙ + ∙H → H: H або H – H 2) HCl H∙ + ∙Cl: → H:Cl: або H – Cl Ковалентний зв'язок за полярністю (симетричністю розташування електронної пари відносно атомів) поділяється на ковалентний полярний та ковалентний неполярний. Ковалентний неполярний зв’язок – зв'язок, утворений атомами з однаковою електронегативністю. Приклад: Н2, О2, N2 Ковалентний полярний зв’язок – зв'язок, утворений атомами, електронегативності яких мало відрізняються. Приклад: HCl, H2O Крім цього зв'язок може утворюватися і за донорно-акцепторним механізмом: один атом (акцептор) дає вільну орбіталь, а другий (донор) віддає неподілену пару електронів.
Приклад: NH4+
3. Йонний зв'язок – хімічний зв'язок між йонами. Природа йонного зв’язку полягає в електростатичному притяганні протилежнозаряджених йонів. Приклад: NaF
Відмінність йонного зв’язку від ковалентного: - не має напрямленості - не має насичуваності Властивості речовин залежать від типи зв’язку: 1) речовини з ковалентним неполярним зв’язком краще розчиняються в неполярних розчинниках 2) речовини з ковалентним полярним зв’язком гарно проводять електричний струм; добре розчиняються в полярних розчинниках. 3) речовини з йонним зв’язком мають високі температури кипіння і плавлення; високу електропровідність у розчинах і розплавах. 4. Металічний зв'язок утворюється внаслідок електростатичного притягання між йонами металу та вільними електронами. Приклад: Атом натрію на останньому енергетичному рівні містить чотири орбіта лі й один валентний електрон, який атом віддає дуже легко. Всі чотири орбіта лі й один електрон останнього рівня атоми натрію у кристалі металу надають для утворення хімічного зв’язку. Виходить, що в кристалі натрію електронів більше значно менше, ніж орбіталей. Це дозволяє електронам у металі вільно переміщуватись, переходячи з однієї орбіта лі на іншу. Такі рухливі електрони називаються усуспільненими або електронним газом. Тому метал можна подати як структуру, що складається з атомів металу, розміщених у вузлах кристалічної гратки, які утримуються за рахунок усуспільнених електронів. Отже, металічний зв'язок зумовлений утворенням електронами усіх атомів речовини єдиної рухливої електронної хмари. Металічний зв’язок є нелокалізованим, тобто таким, що не має певної напрямленості: у ньому беруть участь усі атоми кристалу металу. Контрольні запитання:
Література:
|
||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 276; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.104.103 (0.008 с.) |