
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Положення в ПС і будова атома.Содержание книги
Поиск на нашем сайте
Контрольні запитання:
Література:
Тема 5.8. Інструментальні й абразивні матеріали План 1. Бор і його сполуки.*
1. Бор порівняно мало поширений у природі; загальний вміст його в земній корі становить близько 10-3%. До головних природних сполук бору належать борна кислота H3BO3 і солі борних кислот, з яких найбільш відома бура Na2B4O7∙10H2O. Вільний бор добувають відновленням борного ангідриду В2О3 магнієм. При цьому бор виділяється у вигляді аморфного порошку, забрудненого домішками. Чистий кристалічний бор добувають термічним розкладанням або відновленням його галогені дів, а також розкладанням водневих сполук бору. Він має чорний колір і серед простих речовин за твердістю поступається тільки алмазу. Хоч бор розміщений у ІІІ групі ПС, він за своїми властивостями найбільше подібний до елемента ІV групи – кремнію. У цьому виявляється «діагональна подібність». Так, бор, подібно до кремнію, утворює слабкі кислоти, які не виявляють амфотерних властивостей. Як і кремній, бор утворює сполуки з металами, багато з яких мають велику твердість і високу температуру плавлення. Вода не діє на бор; концентровані сульфатна і нітратна кислоти окислюють його в борну кислоту: B + 3HNO3 → H3BO3 + 3NO2 При кімнатній температурі бор сполучається лише з фтором, на повітрі не окислюється. Якщо нагріти аморфний бор до 700ºС, то він займається і горить: 4B + 3O2 → 2B2O3 При високій температурі бор сполучається з багатьма металами, утворюючи бориди. Найбільшого практичного значення мають оксигеновмісні сполуки бору: В2О3 – кислотний оксид, кислоти – Н3ВО3 (ортоборна) і Н3ВО2 (метаборна), бура. 2. Карбон у природі перебуває у вільному стані і у вигляді численних сполук.
Алмаз – безбарвна, прозора речовина, яка сильно заломлює світлові промені. Він кристалізується в кубічній гранецентрованій решітці. При цьому одна половина атомів розміщується у вершинах і центрах граней одного куба, а друга – у вершинах і центрах граней другого куба, зміщеного відносно першого у напрямі його просторової діагоналі. Атоми карбону в алмазі перебувають у sp3-гібридному стані і утворюють тривимірну тетраедричну сітку, у якій вони зв’язані один з одним ковалентними зв’язками. З усіх простих речовин алмаз має максимальне число атомів, що припадають на одиницю об’єму, - атоми карбону «упаковані» в алмазі дуже щільно. З цим, а також з великою міцністю зв’язків у вуглецевих тетраедрах. Пов’язане те, що за твердістю алмаз переважає всі відомі речовини.
Графіт – темно-сірі кристали з слабким металічним блиском. Він має шарувату решітку. Всі атоми карбону перебувають у стані sp2-гібридизації: кожний з них утворює три ковалентні σ-зв’язки з сусідніми атомами, причому кути між напрямами зв’язків дорівнюють 120º. В результаті виникає плоска сітка, складена з правильних шестикутників, у вершинах яких розміщені ядра атомів карбону. Сусідні шари зв’язані між собою в основному силами Ван дер Ваальса, але частково зв'язок має металічний характер (цим пояснюється порівняно висока електро- і теплопровідність графіту). Окремі шари атомів у кристалі графіту, зв’язані між собою порівняно слабко, легко відокремлюються один від одного (цим пояснюється мала механічна міцність графіту) «Аморфний» вуглець (вугілля) складається з дрібнесеньких кристаликів з невпорядкованою структурою графіту. Найважливіші технічні сорти вугілля: кокс, деревне вугілля, кісткове вугілля та сажа. 3. При низьких температурах вугілля, графіт і особливо алмаз інертні. Якщо їх нагрівати, то активність збільшується: вугілля легко сполучається з киснем і є добрим відновником. При дуже високих температурах вуглець сполучається з воднем, сіркою, кремнієм, бором і багатьма металами. Карбон може утворювати 2 типи оксидів: СО – несолетворний і СО2 – кислотний, якому відповідає слабка нестійка карбонатна кислота Н2СО3. 4. Алмаз широко застосовують у промисловості: майже 80% добутих алмазів використовують для технічних цілей (для обробки різних твердих матеріалів, буріння гірських порід). Завдяки своїй електропровідності графіт застосовується для виготовлення електродів. З суміші графіту з глиною роблять вогнетривкі тиглі для плавлення металів. Змішаний з мастилом графіт є чудовим мастильним засобом. Ізотоп 10В сильно поглинає повільні нейтрони, тому бор і його сполуки застосовуються в ядерній техніці. З них виготовляють регулювальні стержні реакторів. Карбід бору має дуже високу твердість і хімічну стійкість, тому його використовують для обробки твердих сплавів. Буру застосовують в процесі зварювання, різання і паяння металів. Контрольні запитання:
Література:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.74.47 (0.009 с.) |

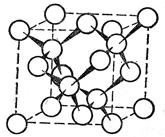 У вільному стані карбон відомий у вигляді алмазу, що кристалізується в кубічній системі, і графіту, що належить до гексагональної системи. Такі форми його, як деревне вугілля, кокс, сажа, мають невпорядковану структуру. Синтетично добуто карбін і полікумулен – різновидності вуглецю, що складаються з лінійних ланцюгових полімерів типу …−С≡С−С≡С−… або …=С=С=С=… Карбін має напівпровідникові властивості. При сильному нагріванні без доступу повітря він перетворюється у графіт.
У вільному стані карбон відомий у вигляді алмазу, що кристалізується в кубічній системі, і графіту, що належить до гексагональної системи. Такі форми його, як деревне вугілля, кокс, сажа, мають невпорядковану структуру. Синтетично добуто карбін і полікумулен – різновидності вуглецю, що складаються з лінійних ланцюгових полімерів типу …−С≡С−С≡С−… або …=С=С=С=… Карбін має напівпровідникові властивості. При сильному нагріванні без доступу повітря він перетворюється у графіт.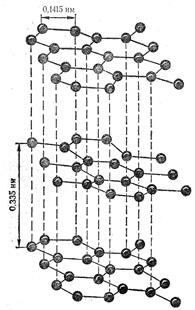 Якщо алмаз сильно нагріти без доступу повітря, то він перетворюється на графіт.
Якщо алмаз сильно нагріти без доступу повітря, то він перетворюється на графіт.


