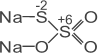Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
СУЛЬФІДИ – солі сульфідної кислотиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
СІРКА (S) Поширення в природі. В природі сірка зустрічається 1) в самородному вигляді: Сицилія, ЗахіднаУкраїна 2) у вигляді мінералів: FeS2 - залізний колчедан (пірит), ZnS цинкова обманка, PbS свинцевий блиск, CuS2 - мідний блиск, HgS –кіновар; 3) у вигляді сульфатів мінерали - CaSO4·2H2O - гіпс, Na2SO4·10H2O мірабіліт, MgSO4·7H2O – англійська гірка сіль 4) у складі живих організмів - білки Будова атома. Розміщення електронів по рівням та підрівням подано на схемі:
Сірка може мати наступні ступені окиснення: S-2 S0 S+4 S+6 H2S (Na2S) S SO2 (H2SO3) SO3 (H2SO4) Фізичні властивості. Тверда кристалічна речовина жовтого кольору, нерозчинна у воді, водою не змочується (плаває на поверхні), tкип = 445ºС Алотропні модифікації. 1) ромбічна (a-сірка) - S8. Найбільш стійка модифікація. t°пл. = 113°C; r = 2,07 г/см3
2) моноклінна (b-сірка) - темно-жовті голки. Стійка при температурі більше 96°С; при звичайних умовах перетворюється на ромбічну. t°пл. = 119°C; r = 1,96 г/см3 3) пластическая – коричнева резиноподібна (аморфна) маса. Нестійка, при затвердінні перетворюється на ромбічну.
Добування 1. Промисловий метод - виплавлення з руди за допомогою водяної пари. 2. Неповне окислення сірководню (при нестачі кисню): 2H2S + O2 ® 2S + 2H2O 3. Реакція Вакенродера: 2H2S + SO2 ® 3S + 2H2O Хімічні властивості І. Окисні властивості сірки (S0 + 2ē ® S-2) 1) Сірка реагує з лужними металами без нагрівання: 2Na + S ® Na2S З іншими металами (крім Au, Pt) - при підвищенній t°: 2Al + 3S ® Al2S3 Zn + S ® ZnS 2) З деякими неметалами сірка утворює бінарні сполуки: H2 + S ® H2S, 2P + 3S ® P2S3, C + 2S ® CS2 ІІ. Відновлювальні властивості сірка виявляє в реакціях з сильними окисниками: (S - 2ē ® S+2; S - 4ē ® S+4; S - 6ē ® S+6) 3) з киснем: S + O2 –t°® S+4O2, 2S + 3O2 –t°;Pt® 2S+6O3 4) з галогенами (крім йоду): S + Cl2 ® S+2Cl2 5) з кислотами - окисниками: S + 2H2SO4(конц) ® 3S+4O2 + 2H2O S + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O ІІІ. Реакції диспропорціонування: 3S0 + 6KOH ® K2S+4O3 + 2K2S-2 + 3H2O S0 + Na2S+4O3 ® Na2S2O3 тіосульфат натрія
Застосування: вулканізація каучуку, отримання ебоніту, виробництво сірників, пороху, в боротьбі з шкідниками сільського господарства, для медичних цілей (сірчані мазі для лікування шкірних захворювань), для отримання сірчаної кислоти і т.д. ГІДРОГЕН СУЛЬФІД
Фізичні властивості. Газ, безбарвний, із запахом тухлих яєць, отруйний, розчинний у воді; t пл. = -86° C; °t кип. = -60 ° С. Добування: 1) H2 + S t°®H2S 2) FeS + 2HCl ® FeCl2 + H2S Хімічні властивості 1) Розчин H2S у воді – слабка двохосновна кислота (сірководнева): H2S «H+ + HS- HS- «H+ + S2- Сірководнева кислота утворює два типи солей - середні (сульфіди) и кислі (гідрогенсульфіди). 2) Кислотні властивості: взаємодіє з металлами, які в ряді напруг знаходяться до водню, основними оксидами, основами, основними солями: H2S + 2Na ® Na2S + 2H2 H2S + 2NaOH ® Na2S + 2H2O 3) Відновні властивості: при нестачі O2: 2H2S-2 + O2 ® 2S0 + 2H2O при надлишку O2: 2H2S-2 + 3O2 ® 2S+4O2 + 2H2O H2S-2 + Br2 ® S0 + 2HBr H2S-2 + 2FeCl3 ® 2FeCl2 + S0 + 2HCl H2S-2 + 4Cl2 + 4H2O ® H2S+6O4 + 8HCl 3H2S-2 + 8HNO3(конц) ® 3H2S+6O4 + 8NO + 4H2O H2S-2 + H2S+6O4(конц) ® S0 + S+4O2 + 2H2O (при нагревании реакція йде по-іншому: H2S-2 + 3H2S+6O4(конц) –t°® 4S+4O2 + 4H2O) 5) Срібло при контакті с сірководнем чорніє: 4Ag + 2H2S + O2 ® 2Ag2S + 2H2O 6) Якісна реакція на сірководень та розчинні сульфіди – утворення чорного осаду PbS: H2S + Pb(NO3)2 ® PbS¯ + 2HNO3 Na2S + Pb(NO3)2 ® PbS¯ + 2NaNO3 Pb2+ + S2- ® PbS¯ Однією з основних причин потемніння художніх картин старих майстрів було використання свинцевих білил, які взаємодіючи зі слідами сірководню в повітрі, перетворювались на PbS чорного кольору. 7) Реставрація картин: PbS + 4H2O2 ® PbSO4 (білий) + 4H2O СУЛЬФІДИ – солі сульфідної кислоти Добування 1) Нагрівання метала з сіркою: Hg + S ® HgS 2) Розчинні сульфіди отримують в реакції сірководню з лугом: H2S + 2KOH ® K2S + 2H2O 3) Нерозчинні сульфіди отримують в реакціях обміну: CdCl2 + Na2S ® 2NaCl + CdS¯ Pb(NO3)2 + Na2S ® 2NaNO3 + PbS¯ ZnSO4 + Na2S ® Na2SO4 + ZnS¯ MnSO4 + Na2S ® Na2SO4 + MnS¯ 2SbCl3 + 3Na2S ® 6NaCl + Sb2S3¯ SnCl2 + Na2S ® 2NaCl + SnS¯ Хімічні властивості 1) Сульфіди металів, що стоять в ряду напруг лівіше заліза (включно), розчиняються в сильних кислотах: ZnS + H2SO4 ® ZnSO4 + H2S HgS + H2SO4 –\® 3) Водорозчинні сульфіди розчиняють сірку з утворенням полісульфідів: Na2S + nS ® Na2Sn+1 (1 £ n £ 5) Полісульфіди при окисненні перетворюються в тіосульфати, наприклад: 2Na2S2 + 3O2 ® 2Na2S2O3 ОКСИДИ СІРКИ СУЛЬФУР (IV) ОКСИД SO2 (СІРЧИСТИЙ АНГІДРИД, СІРЧИСТИЙ ГАЗ)
Фізичні властивості. Безбарвний газ з різким запахом; добре розчинний у воді; °t пл. = -75,5°C; °t кип. = -10°С.Знебарвлює багато барвниів, вбиває мікроорганізми. Получение 1) При згоранні сірки в кисні: S + O2 ® SO2
2) Окислением сульфидов: 4FeS2 + 11O2 ® 2Fe2O3 + 8SO2 3) Обробка солей сірчистої кислоти мінеральними кислотами: Na2SO3 + 2HCl ® 2NaCl + SO2 + H2O 4) При окисненні металів концентрованою сірчаною кислотою: Cu + 2H2SO4(конц) ® CuSO4 + SO2 + 2H2O Хімічні властивості 1) Сірчистий ангідрид - кислотний оксид. При розчиненні у воді утворюється слабка і нестійка сірчиста кислота (існує лише у водному розчині): SO2 + H2O «H2SO3 H2SO3 утворює два типи солей - середні (сульфіти) та кислі (гідрогенсульфіти). Ba(OH)2 + SO2 ® BaSO3¯(барій сульфит бария) + H2O Ba(OH)2 + 2SO2 ® Ba(HSO3)2(гидросульфит бария) 2) Реакції окиснення (S+4 – 2ē ® S+6) SO2 + Br2 + 2H2O ® H2SO4 + 2HBr 5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4 Водні розчини сульфітів лужних металів окислюються на повітрі: 2Na2SO3 + O2 ® 2Na2SO4; 2SO32- + O2 ® 2SO42- 3) Реакції відновлення (S+4 + 4ē ® S0) SO2 + С –t°® S + СO2 SO2 + 2H2S ® 3S + 2H2O СУЛЬФУР (VI) ОКСИД SO3 (сірчаний ангідрид)
Фізичні властивості. Безбарвна летка рідина, °t пл. = 17°C; tкип. = 66°С; на повітрі "димить", сильно поглинає вологу (зберігають в запаяних посудинах). SO3 + H2O ® H2SO4 SO3 добре розчиняється в 100% сірчаній кислоті, цей розчин називається олеумом. Добування 1) 2SO2 + O2 -кат;450°C® 2SO3 2) Fe2(SO4)3 –t°® Fe2O3 + 3SO3 Хімічні властивості 1) При розчиненні у воді утворює сильну сульфатну кислоту: SO3 + H2O ® H2SO4 H2SO4 утворює два типи солей - середні (сульфати) та кислі (гідрогенсульфати): 2NaOH + SO3 ® Na2SO4 + H2O NaOH + SO3 ® NaHSO4 2) SO3 - сильний окисник. 2SO3 + 3С –t°® 2S + 3СO2 SO3 + 3H2S ® 4S + 3H2O СУЛЬФАТНА КИСЛОТА (H2SO4)
Фізичні властивості. Важка масляниста рідина ("купоросне масло"); r = 1,84 г/см3; нелетка, добре розчинна у воді (відбувається сильне розігрівання); °t пл. = 10,3°C, t кип. = 296°С, дуже гігроскопічна, має водовіднімаючі властивості (обвуглює папір, дерева, цукор). Пам’ятайте!!! Кислоту вливають малими порціями у воду, а не навпаки!
Хімічні властивості H2SO4 - сильна двохосновна кислота. H2SO4 «H+ + HSO4- HSO4- «H+ + SO42- H2SO4 утворює два типи солей - середні (сульфати, Na2SO4) та кислі (гідроген сульфати, NaHSO4). 1) Кислотні властивості. Реагує з: а) основними оксидами: CuO + H2SO4 ® CuSO4 + H2O б) гідроксидами: H2SO4 + 2NaOH ® Na2SO4 + 2H2O H2SO4 + Cu(OH)2 ® CuSO4 + 2H2O 2) Вступає в обмінні реакції з солями: BaCl2 + H2SO4 ® BaSO4¯ + 2HCl Утворення білого кристалічного осаду BaSO4 (нерозчинного в кислотах) є якісною реакцією на сульфати. 3) Окисні властивості: a) розбавлена сульфатна кислота розчиняє тільки метали, що стоять в ряду напруг лівіше водню: Zn0 + H2+1SO4(разб) ® Zn+2SO4 + H2O б) концентрована H2+6SO4 – сильний окисник; при взаємодії з металами (крім Au, Pt) може відновлюватись до S+4O2 (якщо метал неактивний), S0 чи H2S-2 (якщо метал лужний чи лужноземельний). Без нагрівання не реагує також з Fe, Al, Cr - пасивуються): 2Ag0 + 2H2+6SO4 ® Ag2+1SO4 + S+4O2 + 2H2O 8Na0 + 5H2+6SO4 ® 4Na2+1SO4 + H2S-2 + 4H2O 4) концентрована H2S+6O4 реагує при нагріванні з деякими неметаллами. При цьому неметали окислюються до найвищого ступеня окиснення і утворюється S+4O2: С0 + 2H2S+6O4(конц) ® C+4O2 + 2S+4O2 + 2H2O S0 + 2H2S+6O4(конц) ® 3S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) ® 5S+4O2 + 2H3P+5O4 + 2H2O Очищення нафтопродуктів Акумулятори. ВУГЛЕЦЬ Електронна будова
Вуглець може мати наступні ступені окиснення: С-4 С0 С+2 С+4 СН4 С СO СО2 Хімічні властивості Вуглець - малоактивний, на холоді реагує тільки з фтором; хімічна активність проявляється при високих температурах. І. Відновні властивості 1) реагує з киснем C0 + O2 –t°® CO2 углекислый газ при нестачі кисню відбувається неповне згорання:
2C0 + O2 –t°®2C+2O угарный газ 2) реагує з фтором С + 2F2 ® CF4
3) вступає в реакцію з водяним паром C0 + H2O –1200°®С+2O + H2 (водяний газ)
4) реагує з оксидами металів C0 + 2CuO –t°® 2Cu + C+4O2
5) вступає в реакцію з кислотами-окисниками: C0 + 2H2SO4(конц.) ® С+4O2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) ® С+4O2 + 4NO2 + 2H2O ІІ. Окисні властивості. 6) з деякими металами утворює карбіди 4Al + 3C0 ® Al4C3 Ca + 2C0 ® CaC2-4 7) з воднем утворює метан C0 + 2H2 ® CH4 Застосування вуглецю. 1. Сажу використовують як наповнювач при виробництві гуми і як друкарську фарбу. 2. Сполуки вуглецю - кам'яне вугілля, природний газ, нафта - паливо. 3. Відновлювач в металургії. 4. Адсорбент. КАРБОН (II) ОКСИД - CO Чадний газ; безкольоровий, без запаху, малорозчинний у воді, розчинний в органічних розчинниках, токсичний, t°кип = -192°C; t пл. = -205°C. Ступінь окислювання вуглецю в СО +2, але валентність дорівнює 3. два ковалентних зв'язки утворюються за обмінним механізмом і один зв'язок по донорно-акцепторному (вільна орбіталь належить збудженому атому вуглецю, а пара електронів - кисню). Добування 1) В промисловості (в газогенераторах): C + O2 ® CO2 CO2 + C ® 2CO 2) В лабораторії - термічним розкладом мурашиної або щавелевої кислот в присутності H2SO4(конц.): HCOOH ® H2O + CO H2C2O4 ® CO + CO2 + H2O Хімічні властивості. При звичайних умовах CO інертний; при нагріванні – виявляє відновні властивості; несолетвірний оксид. Вступає в реакції з: 1)киснем: 2C+2O + O2 ® 2C+4O2 2) оксидами металів: C+2O + CuO ® Сu + C+4O2 3) хлором (на світлі): CO + Cl2 –hn® COCl2(фосген) 4) розплавом лугу (під тиском):CO + NaOH ® HCOONa (форміат натрію) 5) перехідними металами утворює карбоніли: Ni + 4CO –t°®Ni(CO)4, Fe + 5CO –t°®Fe(CO)5 КАРБОН (IV) ОКСИД - СO2 (ВУГЛЕКИСЛИЙ ГАЗ) Молекула СО2 має лінійну будову (О = С = О) і малополярна. Тому діоксид вуглецю погано розчинний у воді. Він важчий за повітря і накопичується в колодязях, погребах, витісняючи кисень і може бути причиною задухи. Вуглекислий газ, безбарвний, без запаху; t пл. = -78,5ºC (твердий CO2 називається "сухий лід"); не підтримує горіння. Добування 1. Термічний розклад карбонатів: CaCO3–t°® CaO + CO2 2. Дією сильних кислот на карбонати та гідрогенкарбонати: CaCO3 + 2HCl ® CaCl2 + H2O + CO2 NaHCO3 + HCl ® NaCl + H2O + CO2 Способи збирання
Хімічні властивості Виявляє кислотні властивості та реагує з основними оксидами, основами, утворюючи карбонати. Na2O + CO2 ® Na2CO3 2NaOH + CO2 ® Na2CO3 + H2O NaOH + CO2 ® NaHCO3 При підвищеній температурі може виявляти окисні властивості:С+4O2 + 2Mg –t°® 2Mg+2O + C0 Якісна реакція: помутніння вапняної води - Ca(OH)2 + CO2 ® CaCO3¯(белый осадок) + H2O
Воно зникає при тривалому пропусканні CO2 через вапняну воду, тому що нерозчинний карбонат кальцію переходить в розчинний гідрокарбонат: CaCO3 + H2O + CO2 ® Сa(HCO3)2 КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ (H2CO3)
Кислота слабка, існує лише у водному розчині: CO2 + H2O «H2CO3 Двохосновна: H2CO3 «H+ + HCO3- HCO3- «H+ + CO32- Характерні кислотні властивості та реагує з основними оксидами, основами, утворюючи карбонати. Na2O + H2CO3 ® Na2CO3 + H2O 2NaOH + H2CO3 ® Na2CO3 + 2H2O NaOH + CO2 ® NaHCO3. Карбонатна кислота утворює 2 типи солей: середні солі - карбонати (СO32-) та кислі солі гідрокарбонати (HCO3-). Карбонати та гідрокарбонати можуть перетворюватись один в одного: 2NaHCO3 –t°® Na2CO3 + H2O + CO2 Na2CO3 + H2O + CO2 ® 2NaHCO3 Карбонати металів (крім лужних) при нагріванні декарбоксилуються з утворенням оксидів: CuCO3 –t°® CuO + CO2 Якісна реакція - "скипання" при дії сильної кислоти: Na2CO3 + 2HCl ® 2NaCl + H2O + CO2 Застосування карбонатів 1. Na2CO3·10H2O - кристалічна сода, Na2CO3 - кальцинована сода - миючий засіб, виробництво скла, мила, паперу. 2. NaHCO3 - гідрокарбонат натрію - питна сода. 3. K2CO3 - карбонат калію, поташ - виробництво мила, скла. 4. СaCO3 - вапняк, крейда, мармур - будматеріали. КРЕМНІЙ Відкритий Ж. Гей-Люссаком и Л.Тенаром в 1811р. Другий по розповсюдженості елемент в земній корі (27,6% по масі)
Можливі ступнеі окиснення Si-4 Si0 Si+4 SiН4 Si SiО2 Алотропія 1. Кристалічний - темно-сіра речовина з металевим блиском, велика твердість, крихкий, напівпровідник; r = 2,33г/см3, tпл. = 1415°C; tкип. = 2680°C. Має алмазоподібну структуру (sp3-гібридизація атомів кремнію) і утворює міцні ковалентні s-зв'язки. Інертний. 2. Аморфний - бурий порошок, гігроскопічний, алмазоподібна структура, r = 2 г/см3, більш реакційноздатний. Добування 1) в промисловості: 2С + Si+4O2 –t°® Si0 + 2CO 2) в лабораторії: 2Mg + Si+4O2 –t°® 2MgO + Si0 Хімічні властивості Типовий неметал, інертний. І. Відновні властивості. Реагує з: 1) киснем: Si0 + O2 –t°® Si+4O2 2) фтором (без нагрівання): Si0 + 2F2 ® SiF4 3) вуглецем: Si0 + C –t°® Si+4C (SiC - карборунд -твердий; використовується для шліфування) 4) сумішю нітратної та плавикової кислот: 3Si + 4HNO3 + 18HF ® 3H2[SiF6] + 4NO + 8H2O 6) лугами при нагріванні: Si0 + 2NaOH + H2O ® Na2Si+4O3+ 2H2 ІІ. Окисні властивості. Реагує з металлами (утворюються силіциди): Si0 + 2Mg –t°® Mg2Si-4 Застосування кремнію. Виготовлення напівпровідникових приладів (електроніка), фотоелементів (в т.ч. енергетичних), жаростійких сплавів (феросиліцій). СИЛАН SiH4 Безкольоровий, отруйний газ, t°пл. = -185°C, t°кип. = -112°C. Добування: Mg2Si + 4HCl ® 2MgCl2 + SiH4 СИЛІКАТНІ КИСЛОТИ
H2SiO3 - метасилікатна кислота H4SiO4 - ортосилікатна кислота. H2SiO3 – дуже слабка (слабша карбонатної), нестійка, у воді утворює колоїдний розчин, не має кислого смаку. Добування Na2SiO3 + 2HCl ® 2NaCl + H2SiO3¯ Хімічні властивості: 1. При нагріванні розкладається: H2SiO3 –t°® H2O + SiO2 2. Виявляє слабкі кислотні властивості: Н2SiO3 + 2NaOH ® Na2SiO3 +2H2O Солі силікатної кислоти - силікати. СИЛІКАТНА ПРОМИСЛОВІСТЬ Скло 1. Кварцове скло - виготовляють шляхом переплавки кварцу (SiO2). Має низький температурний коефіцієнт розширення і добре переносить різкі зміни температури.
2. Віконне скло - загальна формула - Na2O·CaO·SiO2. Отримують сплавлением соди, вапняку і білого піску. Сумарно процес виглядає так: Na2CO3 + CaCO3 + 6SiO2 = Na2O·CaO·6SiO2 + 2CO2 За стадіями: 1. Na2CO3 + SiO2 = Na2SiO3 + CO2; 2. CaCO3 + SiO2 = CaSiO3 + CO2; 3. CaSiO3 + Na2SiO3 + 4SiO2 = Na2O·CaO·6SiO2 3. Термостійке скло (калійне - К2O·CaO·6SiO2). Для отримання використовують K2CO3, а в іншому процес не відрізняється від виробництва віконного скла. 4. Боратне (пробіркове) скло, жаростійке. Його отримують так само як і віконне скло, однак, замість СаО використовують оксид бора - B2O3. 4. Кришталь. Це калієве скло, яке замість СаО, містить оксид свинцю, має склад - K2O·PbO·6SiO2 5. Кольорове скло. Для його отрамання використовують різні добавки: оксиду кобальту - СоО (синє), оксиду хрому - Cr2O3 (зелене), оксиду міді Cu2O (червоне) і т.п. Кераміка Це вироби з глини. Тонка кераміка - фарфор і фаянс, груба кераміка - цегла, черепиця, труби. Основною реакцією при випаленні глини є видалення хімічно зв'язаної води та утворення каменеподібної маси: 3Al2O3·2SiO2·2H2O = 6H2O + 4SiO2 + 3Al2O3·2SiO2 Цемент Отримують шляхом випалення при 1400-1600ºС суміші вапняку та глини, з подальшим розмеленням спеченої маси в тонкий порошок. Головними компонентами є: CaO - 64-67%, SiO2 - 21-24% та Al2O3 - 4-7%. В процесі затвердіння цементу розрізняють дві стадії: спочатку йде взаємодія молекул води з частинками цементу з вивільненням гідроксиду кальцію, який далі, взаємодіючи з вуглекислим газом повітря і діоксидом кремнію (є в цементі), утворює міцні кристали карбонатів і силікатів кальцію, що скріплюють зерна цементу. 3CaO·SiO2 + 3H2O = 2CaO·SiO2·2H2O + Ca (OH)2 Са (OH)2 + CO2 = CaCO3 + H2O; Ca (OH)2 + SiO2 = CaSiO3 + H2O СІРКА (S) Поширення в природі. В природі сірка зустрічається 1) в самородному вигляді: Сицилія, ЗахіднаУкраїна 2) у вигляді мінералів: FeS2 - залізний колчедан (пірит), ZnS цинкова обманка, PbS свинцевий блиск, CuS2 - мідний блиск, HgS –кіновар; 3) у вигляді сульфатів мінерали - CaSO4·2H2O - гіпс, Na2SO4·10H2O мірабіліт, MgSO4·7H2O – англійська гірка сіль 4) у складі живих організмів - білки Будова атома. Розміщення електронів по рівням та підрівням подано на схемі:
Сірка може мати наступні ступені окиснення: S-2 S0 S+4 S+6 H2S (Na2S) S SO2 (H2SO3) SO3 (H2SO4) Фізичні властивості. Тверда кристалічна речовина жовтого кольору, нерозчинна у воді, водою не змочується (плаває на поверхні), tкип = 445ºС Алотропні модифікації. 1) ромбічна (a-сірка) - S8. Найбільш стійка модифікація. t°пл. = 113°C; r = 2,07 г/см3
2) моноклінна (b-сірка) - темно-жовті голки. Стійка при температурі більше 96°С; при звичайних умовах перетворюється на ромбічну. t°пл. = 119°C; r = 1,96 г/см3 3) пластическая – коричнева резиноподібна (аморфна) маса. Нестійка, при затвердінні перетворюється на ромбічну.
Добування 1. Промисловий метод - виплавлення з руди за допомогою водяної пари. 2. Неповне окислення сірководню (при нестачі кисню): 2H2S + O2 ® 2S + 2H2O 3. Реакція Вакенродера: 2H2S + SO2 ® 3S + 2H2O Хімічні властивості І. Окисні властивості сірки (S0 + 2ē ® S-2) 1) Сірка реагує з лужними металами без нагрівання: 2Na + S ® Na2S З іншими металами (крім Au, Pt) - при підвищенній t°: 2Al + 3S ® Al2S3 Zn + S ® ZnS 2) З деякими неметалами сірка утворює бінарні сполуки: H2 + S ® H2S, 2P + 3S ® P2S3, C + 2S ® CS2 ІІ. Відновлювальні властивості сірка виявляє в реакціях з сильними окисниками: (S - 2ē ® S+2; S - 4ē ® S+4; S - 6ē ® S+6) 3) з киснем: S + O2 –t°® S+4O2, 2S + 3O2 –t°;Pt® 2S+6O3 4) з галогенами (крім йоду): S + Cl2 ® S+2Cl2 5) з кислотами - окисниками: S + 2H2SO4(конц) ® 3S+4O2 + 2H2O S + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O ІІІ. Реакції диспропорціонування: 3S0 + 6KOH ® K2S+4O3 + 2K2S-2 + 3H2O S0 + Na2S+4O3 ® Na2S2O3 тіосульфат натрія
Застосування: вулканізація каучуку, отримання ебоніту, виробництво сірників, пороху, в боротьбі з шкідниками сільського господарства, для медичних цілей (сірчані мазі для лікування шкірних захворювань), для отримання сірчаної кислоти і т.д. ГІДРОГЕН СУЛЬФІД
Фізичні властивості. Газ, безбарвний, із запахом тухлих яєць, отруйний, розчинний у воді; t пл. = -86° C; °t кип. = -60 ° С. Добування: 1) H2 + S t°®H2S 2) FeS + 2HCl ® FeCl2 + H2S Хімічні властивості 1) Розчин H2S у воді – слабка двохосновна кислота (сірководнева): H2S «H+ + HS- HS- «H+ + S2- Сірководнева кислота утворює два типи солей - середні (сульфіди) и кислі (гідрогенсульфіди). 2) Кислотні властивості: взаємодіє з металлами, які в ряді напруг знаходяться до водню, основними оксидами, основами, основними солями: H2S + 2Na ® Na2S + 2H2 H2S + 2NaOH ® Na2S + 2H2O 3) Відновні властивості: при нестачі O2: 2H2S-2 + O2 ® 2S0 + 2H2O при надлишку O2: 2H2S-2 + 3O2 ® 2S+4O2 + 2H2O H2S-2 + Br2 ® S0 + 2HBr H2S-2 + 2FeCl3 ® 2FeCl2 + S0 + 2HCl H2S-2 + 4Cl2 + 4H2O ® H2S+6O4 + 8HCl 3H2S-2 + 8HNO3(конц) ® 3H2S+6O4 + 8NO + 4H2O H2S-2 + H2S+6O4(конц) ® S0 + S+4O2 + 2H2O (при нагревании реакція йде по-іншому: H2S-2 + 3H2S+6O4(конц) –t°® 4S+4O2 + 4H2O) 5) Срібло при контакті с сірководнем чорніє: 4Ag + 2H2S + O2 ® 2Ag2S + 2H2O 6) Якісна реакція на сірководень та розчинні сульфіди – утворення чорного осаду PbS: H2S + Pb(NO3)2 ® PbS¯ + 2HNO3 Na2S + Pb(NO3)2 ® PbS¯ + 2NaNO3 Pb2+ + S2- ® PbS¯ Однією з основних причин потемніння художніх картин старих майстрів було використання свинцевих білил, які взаємодіючи зі слідами сірководню в повітрі, перетворювались на PbS чорного кольору. 7) Реставрація картин: PbS + 4H2O2 ® PbSO4 (білий) + 4H2O СУЛЬФІДИ – солі сульфідної кислоти Добування 1) Нагрівання метала з сіркою: Hg + S ® HgS 2) Розчинні сульфіди отримують в реакції сірководню з лугом: H2S + 2KOH ® K2S + 2H2O 3) Нерозчинні сульфіди отримують в реакціях обміну: CdCl2 + Na2S ® 2NaCl + CdS¯ Pb(NO3)2 + Na2S ® 2NaNO3 + PbS¯ ZnSO4 + Na2S ® Na2SO4 + ZnS¯ MnSO4 + Na2S ® Na2SO4 + MnS¯ 2SbCl3 + 3Na2S ® 6NaCl + Sb2S3¯ SnCl2 + Na2S ® 2NaCl + SnS¯ Хімічні властивості 1) Сульфіди металів, що стоять в ряду напруг лівіше заліза (включно), розчиняються в сильних кислотах: ZnS + H2SO4 ® ZnSO4 + H2S HgS + H2SO4 –\® 3) Водорозчинні сульфіди розчиняють сірку з утворенням полісульфідів: Na2S + nS ® Na2Sn+1 (1 £ n £ 5) Полісульфіди при окисненні перетворюються в тіосульфати, наприклад: 2Na2S2 + 3O2 ® 2Na2S2O3 ОКСИДИ СІРКИ СУЛЬФУР (IV) ОКСИД SO2 (СІРЧИСТИЙ АНГІДРИД, СІРЧИСТИЙ ГАЗ)
Фізичні властивості. Безбарвний газ з різким запахом; добре розчинний у воді; °t пл. = -75,5°C; °t кип. = -10°С.Знебарвлює багато барвниів, вбиває мікроорганізми. Получение 1) При згоранні сірки в кисні: S + O2 ® SO2 2) Окислением сульфидов: 4FeS2 + 11O2 ® 2Fe2O3 + 8SO2 3) Обробка солей сірчистої кислоти мінеральними кислотами: Na2SO3 + 2HCl ® 2NaCl + SO2 + H2O 4) При окисненні металів концентрованою сірчаною кислотою: Cu + 2H2SO4(конц) ® CuSO4 + SO2 + 2H2O Хімічні властивості 1) Сірчистий ангідрид - кислотний оксид. При розчиненні у воді утворюється слабка і нестійка сірчиста кислота (існує лише у водному розчині): SO2 + H2O «H2SO3 H2SO3 утворює два типи солей - середні (сульфіти) та кислі (гідрогенсульфіти). Ba(OH)2 + SO2 ® BaSO3¯(барій сульфит бария) + H2O Ba(OH)2 + 2SO2 ® Ba(HSO3)2(гидросульфит бария) 2) Реакції окиснення (S+4 – 2ē ® S+6) SO2 + Br2 + 2H2O ® H2SO4 + 2HBr 5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4 Водні розчини сульфітів лужних металів окислюються на повітрі: 2Na2SO3 + O2 ® 2Na2SO4; 2SO32- + O2 ® 2SO42- 3) Реакції відновлення (S+4 + 4ē ® S0) SO2 + С –t°® S + СO2 SO2 + 2H2S ® 3S + 2H2O СУЛЬФУР (VI) ОКСИД SO3 (сірчаний ангідрид)
Фізичні властивості. Безбарвна летка рідина, °t пл. = 17°C; tкип. = 66°С; на повітрі "димить", сильно поглинає вологу (зберігають в запаяних посудинах). SO3 + H2O ® H2SO4 SO3 добре розчиняється в 100% сірчаній кислоті, цей розчин називається олеумом. Добування 1) 2SO2 + O2 -кат;450°C® 2SO3 2) Fe2(SO4)3 –t°® Fe2O3 + 3SO3 Хімічні властивості 1) При розчиненні у воді утворює сильну сульфатну кислоту: SO3 + H2O ® H2SO4 H2SO4 утворює два типи солей - середні (сульфати) та кислі (гідрогенсульфати): 2NaOH + SO3 ® Na2SO4 + H2O NaOH + SO3 ® NaHSO4 2) SO3 - сильний окисник. 2SO3 + 3С –t°® 2S + 3СO2 SO3 + 3H2S ® 4S + 3H2O СУЛЬФАТНА КИСЛОТА (H2SO4)
Фізичні властивості. Важка масляниста рідина ("купоросне масло"); r = 1,84 г/см3; нелетка, добре розчинна у воді (відбувається сильне розігрівання); °t пл. = 10,3°C, t кип. = 296°С, дуже гігроскопічна, має водовіднімаючі властивості (обвуглює папір, дерева, цукор). Пам’ятайте!!! Кислоту вливають малими порціями у воду, а не навпаки!
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 922; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.89.112 (0.015 с.) |