
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие частично растворимых жидкостейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
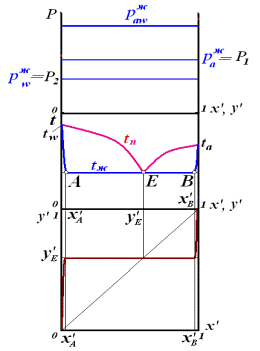
Системы, компоненты которых растворимы друг в друге в строго определенных для каждой температуры пределах концентраций, а вне этих пределов образуют два несмешивающихся жидких слоя
т.А – соответствует составу 1. 0 < x’F < x’A и x’B < x’F < 1 полная растворимость (1 жидкая фаза),пары равновесны с жидкостью 2. x’A < x’F < x’B 2 жидкие фазы, состава x’A и x’B Жидкости, образующие кривые растворимости первого типа (эвтектического класса) x’A < y’E < x’B 2) Гетероазеотропом называется гетерогенная жидкая система, состоящая из 2-х ограниченно смешивающихся жидкостей, общий состав которой совпадает с составом пара, равновесного с 2-мя жидкими фазами. В системе с гетероазеотропом пар имеет состав, промежуточный между составами сосуществующих с ними жидких фаз. Гетерогенная смесь имеет наименьшую t кипения по сравнению с t кипения смесей любого другого состава и ее нельзя разделить методом перегонки на чистые компоненты. (вода-анилин, бензол). ГАС используются для разделения АС. Если пары, находящиеся в равновесии с 2-мя жидкими фазами составов . изменении концентрации НКК в жидкости от Жидкости, у которых в гетерогенной области существования состав равновесного пара выходит за пределы
При 1) 0 < x’F < x’A x’B < x’F < 1
2) x’A < x’F < x’B
при давлении р1ниже температуры tE паров нет При повышении давления до р2 гетероазеотроп превращается в гомоазеотроп
Жидкости, образующие кривые растворимости второго типа (неэвтектического класса) xA < xB < yE
1) 0 < xF < xA полная растворимость(1 ж.ф. и 1 п.ф.),пары равновесны с жидкостью 2) xA < xF < xB, 2 ж.ф., состава, xA и xB и 1 п.ф. 3) xB < xF < 1,1 ж.ф. и 1 п.ф. Везде a – НКК, w – ВКК
РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ 1) в.п. насыщенный 2 ж.ф. + 1 п.ф.
Для т. С:
2) в.п. перегретый 1 ж.ф. + 1 п.ф.
Способы перегонки жидкостей
1) однократное испарение ОИ, 2) многократное испарение МИ, 3) постепенное испарение Однократное испарение - до конца процесса образующиеся фазы не разделяются
- образующиеся фазы разделяются в несколько приемов, т.е. несколько раз повторяется процесс ОИ Постепенное испарение - - образующиеся пары непрерывно отводятся; является пределом многократного испарения (перегонка из колбы Энглера)
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 631; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |

 1) Это смеси, растворяющиеся друг в друге при определенной температуре в каком-то пределе, а за пределами температуры имеют 2 жидкие фазы.
1) Это смеси, растворяющиеся друг в друге при определенной температуре в каком-то пределе, а за пределами температуры имеют 2 жидкие фазы. при температуре t, т.В -
при температуре t, т.В -  . В областях от
. В областях от 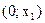 и
и 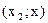 - образуется однофазная гомогенная система и жидкости будут взаимно растворимы. При составе смеси
- образуется однофазная гомогенная система и жидкости будут взаимно растворимы. При составе смеси 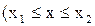 ) образуются 2 жидкие фазы с концентрацией компонента
) образуются 2 жидкие фазы с концентрацией компонента 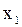 в одной фазе и
в одной фазе и 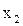 в другой фазе. С изменением температуры изменяется область концентраций
в другой фазе. С изменением температуры изменяется область концентраций 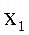 -
- 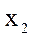 в пределах которой существуют 2 ж.фазы. При температуре выше
в пределах которой существуют 2 ж.фазы. При температуре выше  система 2-х жидкостей образует гомогенный раствор при их смешении в любых соотношениях. В равновесии с 2-мя жидкостями находится паровая фаза определенного состава. Равновесие допустимо в пределах
система 2-х жидкостей образует гомогенный раствор при их смешении в любых соотношениях. В равновесии с 2-мя жидкостями находится паровая фаза определенного состава. Равновесие допустимо в пределах 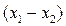 . За пределами этой области равновесная концентрация зависит от состава жидкой фазы.
. За пределами этой области равновесная концентрация зависит от состава жидкой фазы.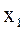 и
и  , имеют равновесный состав
, имеют равновесный состав  <
<  <
< 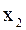 - то это эвтектический класс ЧСЖ. В этом случае при некоторой концентрации
- то это эвтектический класс ЧСЖ. В этом случае при некоторой концентрации 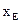 в системе образуется азеотроп, определяющий t кипения смеси в интервале
в системе образуется азеотроп, определяющий t кипения смеси в интервале 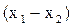 . При изменении концентрации НКК в жидкости от
. При изменении концентрации НКК в жидкости от 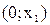 t системы будет понижаться от
t системы будет понижаться от  до
до 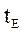 . Концентрация НКК в п.ф изменится от
. Концентрация НКК в п.ф изменится от 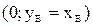 . При изменении концентрации НКК в жидкости от
. При изменении концентрации НКК в жидкости от  ) образуется 2 ж.ф с
) образуется 2 ж.ф с 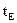
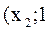 ) – образуется гомогенный раствор, t кипения изменится
) – образуется гомогенный раствор, t кипения изменится  . Например к такому относится система вода-фурфурол.
. Например к такому относится система вода-фурфурол.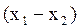 - то это неэвтектический класс ЧСЖ. Например, вода-фенол. При изменении концентрации НКК в жидкости от
- то это неэвтектический класс ЧСЖ. Например, вода-фенол. При изменении концентрации НКК в жидкости от 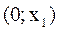 - система однофазна,
- система однофазна, 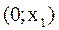 t системы будет понижаться от
t системы будет понижаться от  до
до 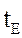 . В области составов смеси
. В области составов смеси  tкип.=
tкип.= 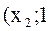 ) – состав паров изменится
) – состав паров изменится 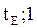 , t кипения изменится
, t кипения изменится 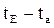 , система будет иметь 1 жидкую фазу. Состав равновесных паров смеси 2-го класса богаче НКК, чем жид-ть.
, система будет иметь 1 жидкую фазу. Состав равновесных паров смеси 2-го класса богаче НКК, чем жид-ть.

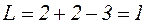
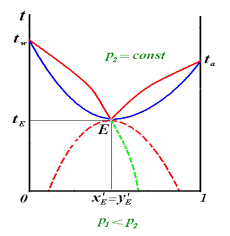
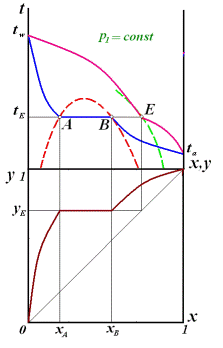
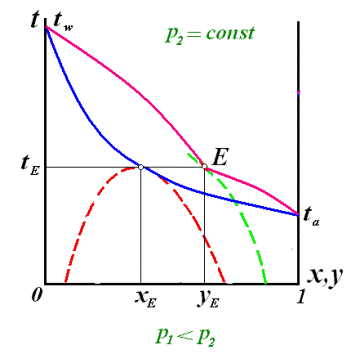 При повышении давления до р2 компоненты растворимы полностью
При повышении давления до р2 компоненты растворимы полностью
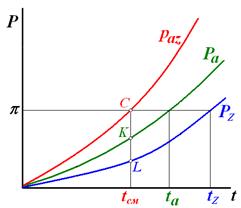
 ;
; 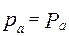 ;
;  ;
; 
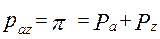

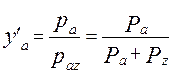 ;
; 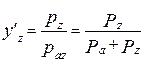 ;
;  ;
; 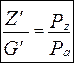


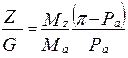

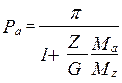
 Три способа:
Три способа:
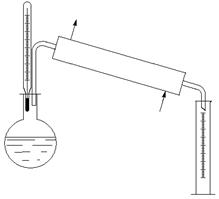 Многократное испарение -
Многократное испарение -


