
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация основных процессов и аппаратов по способу создания движущей силыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Классификация основных процессов и аппаратов по способу создания движущей силы процессы (и аппараты) – массообменные, гидромеханические, механические, тепловые, химические. Массообменные процессы - переход вещества из одной фазы в другую за счет диффузии 1) тв→ж растворение твердых веществ; ж →тв кристаллизация; ж → ж экстракция; ж →г испарение жидкости, десорбция; г → ж конденсация паров, абсорбция; ж↔ п ректификация; тв→г возгонка, десорбция; г →тв адсорбция. Движущая сила: разность концентраций вещества между соответствующими фазами системы Скорость определяется законами массопередачи. Гидромеханические процессы связаны с переработкой суспензий Суспензия – неоднородная система, состоящая из жидкости или газов и взвешенных в них твердых или жидких частиц 1) перемещение жидкости или газа; 2) перемешивание в жидкой среде; 3) разделение жидких неоднородных систем (осаждение, фильтрование, центрифугирование); 4) очистка газов от пыли. Движущая сила: разность давлений, обусловленная разностью плотностей. Скорость определяется законами гидромеханики Механические процессы связаны с обработкой твердых тел и их перемещением 1) измельчение; 2) рассев; 3) транспортирование; 4) дозирование; 5) смешение. Движущая сила: разность сил, давлений, градиент напряжений (сдвиг, растяжение) Скорость определяется законами механики твердых тел Тепловые процессы связаны с теплообменом 1) нагревание; 2) охлаждение; 3) испарение; 4) конденсация; 5) плавление; 6) затвердевание; 7) выпаривание; 8) кристаллизация. Движущая сила: разность температур Скорость определяется законами теплопередачи Химические процессы связаны с химическими превращениями участвующих в процессе веществ и получением новых соединений 1) каталитический крекинг; 2) гидроочистка; 3) риформинг; 4) пиролиз и т.д. Движущая сила: разность концентраций реагирующих веществ Скорость определяется законами химической кинетик КЛАССИФИКАЦИЯ АППАРАТОВ
Периодические процессы Характеризуются неустановившимся состоянием во времени Работа делится на определенные циклы, в течение которых осуществляются все стадии процесса Непрерывные процессы Характеризуются установившимся режимом, не зависящим от времени Обеспечивается непрерывный подвод сырья и вывод продуктов, установившееся состояние – среднестатическое Основные признаки массообменных процессов 1) применяют для разделения смесей, 2) участвуют две фазы, 3) вещество переходит из одной фазы в другую за счет диффузии, 4) движущей силой является разность концентраций, y - yp
5) все массообменные процессы обратимы, направление процесса определяется законами фазового равновесия, фактическими концентрациями компонента в фазах и внешними условиями (t, p), 6) переход вещества из одной фазы в другую заканчивается при достижении динамического равновесия. Основное уравнение массопередачи Скорость массопередачи:
Ky – коэффициент скорости или массопередачи Разность концентраций изменяется во времени, поэтому используем среднюю величину движущей силы:
Размерность коэффициента массопередачи
Размерность движущей силы кг/м3, кг/кг, м3/м3, моль/моль, моль/м3; для газовых фаз: кГ/см2, Па, мм рт.ст. и т.д. Основное уравнение массопередачи по жидкой фазе
За 1 час:
Материальный баланс массообменного процесса Цель составления состоит в выявлении всех участвующих в процессе потоков вещества и энергии с учетом потерь. Мат.баланс позволяет рассчитать внешние потоки вещества и энергии (потоки, входящие в данную систему и покидающие ее).
Переход вещества: G → L
Интегрируем по всему аппарату:
Интегрируем до сечения а-а:
Рабочая линия
из урав (3) →
В координатах x-y уравнение раб.линии – уравнение прямой, где
Уравн раб линии для верхней части колонны G=g+D,для ННК: Gy=gx+DyD отсюда g/D=yD-y/y-x или y=g*x/(g+D)+D*yD/(g+D) Ур раб линии для нижней части g=G+W, для ННК:gx=Gy+Wxw отсюда G/W=x-xw/y-x или y=(G+W)*x/G – W*xw/G
1 2 В зависимости от того, в каком направлении переносится компонент, расположение рабочей линии и линии равновесия может быть разное. На правом рисунке перенос компонента происходит из фазы G в фазу L, при этом движущая сила равна в фазе G: На левом рисунке перенос компонента происходит из фазы L в фазу G, при этом движущая сила равна в фазе G: Пересечение или касание рабочей и равновесной линий означает, что процесс не может идти в заданных пределах
Число единиц переноса (ЧЕП)
ЧЕП показывает, сколько единиц вещества переходит в другую фазу при величине движущей силы, равной единице
Теоретическая тарелка, ВЭТТ
1) Теоретическая тарелка – контактное устройство, обеспечивающее получение равновесных потоков фаз, покидающих контактную зону. Одна ТТ – одно изменение концентраций по жидкой фазе и одно изменение по паровой фазе. ТТ используют при расчетах массообменных аппаратов, когда нужно учитывать время контакта фаз, необходимое для достижения равновесия. Преимуществом метода ТТ является то, что нужно иметь только уравнение равновесия и уравнение рабочей линий. Вместо понятия ТТ используют ЧТТ. ЧТТ зависит от взаимного расположения рабочей и равновесной линии 2)
объединяя урав (1) и (2), интегрируем →
где H, S –высота и сечение ап/та, G –расход ф.G [кг/с],
из урав (5) →
Правило фаз ГИББСА Равновесной системой называется такая система, которая может существовать неограниченно долго без каких-либо качественных или количественных изменений. Состояние равновесия характеризуется правилом фаз Гиббса, которое определяет связь между числом степеней свободы, числом ее компонентов и числом фаз. Число независимых параметров, которые могут быть выбраны произвольно, чтобы привести систему в состояние равновесия – число степеней свободы.
В качестве степеней свободы могут выступать t,P,c Для 2-х компонентной системы взаимно растворимых жидкостей L=2, а для нерастворимых L=1 Вывод уравнения: 1) Пусть система содержит N фаз и n компонентов в каждой фазе. 2) Состояние фаз фиксировано при Р и Т. 3) Состав каждой фазы можно рассчитать, задавая n-1 концентраций компонентов, а концентрация одного из компонентов является зависимой величиной и может быть рассчитана из условия, что сумма мольных долей всех компонентов в смеси равна 1. 4) 5) 6) Число уравнений не может превышать числа переменных, иначе уравнения будут несовместимыми. Разность между числом независимых переменных и числом уравнений равна числу произвольно изменяемых параметров в данной системе, меняя которые можно не менять число фаз в ней (степень свободы):
ПРИМЕНЕНИЕ ПРАВИЛА ФАЗ К ПРОЦЕССАМ ПЕРЕГОНКИ Компонентами системы называются те составные части, концентрация которых может претерпевать изменения в различных фазах. Состояние равновесия подчиняется правилу фаз Гиббса: L = n + 2 – N
Кривая равновесия фаз
По закону Рауля парциальные давления в жидкой фазе определяются: для НКК - для ВКК - По закону Дальтона парциальное давление в паровой фазе определяется: для НКК - для ВКК - При равновесии парциальные давления каждого компонента в паровой и жидкой фазах равны:
разделим урав (1) на (2) →
Уравнение устанавливает зависимость между равновесными концентрациями в жидкой и паровой фазах. Каждой точке на КРФ соответствует определенная температура в пределах температур кипения НКК (
Способы перегонки жидкостей
1) однократное испарение ОИ, 2) многократное испарение МИ, 3) постепенное испарение Однократное испарение - до конца процесса образующиеся фазы не разделяются
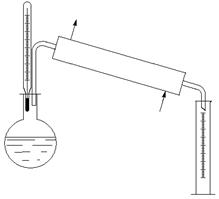
- образующиеся фазы разделяются в несколько приемов, т.е. несколько раз повторяется процесс ОИ Постепенное испарение - - образующиеся пары непрерывно отводятся; является пределом многократного испарения (перегонка из колбы Энглера)
Постепенное испарение Процесс осуществляется так, что пары, образовавшиеся при испарении, удаляются из системы непрерывно в момент их образования. Образовавшиеся в системе паровая и жидкая фазы всегда находятся в состоянии равновесия.
dg - часть испарившейся жидкости, dx – изменившийся состав жидкой фазы, (x-dx) – новый состав жидкости, y – состав паровой фазы. Из уравнения (1) →
подставим урав (4) в урав (2) →
2)
После увеличения температуры: dg – испаряется, состав y, g-dg - неиспарившаяся жидкость, состава x-dx.
Материальный баланс:
Уравнение Рейлея
Постепенная конденсация
Из уравнения (1) →
подставим урав (4) в урав (2) →
2)
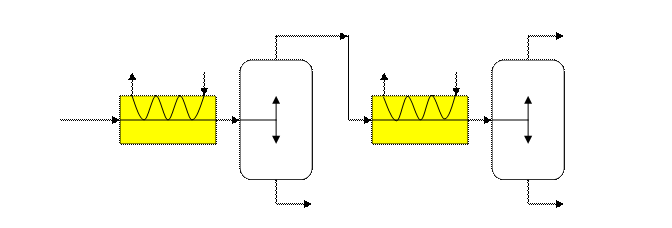
Многократное испарение Процесс многократного испарения состоит из повторений процесса однократного испарения для более полного разделения исходной смеси.
сепаратор сепаратор F испаритель
Пусть многократному испарению подвергается смесь с содержанием НКК Проводим ОИ при тем-ре
ОИ обеспечивает больший отгон, но жидкая фаза содержит больше НКК, т.е. разделение при МИ лучше. При уменьшении перепадов температур и увеличении числа ступеней МИ переходит в пределе в постепенное испарение
33. Многократная конденсация
F
При охлаждении паров с начальной концентрацией НКК
Масса парового остатка: На второй ступени паровой остаток охлаждается от
После к-ой ступени конденсации, масса остатка будет:
Процесс МК: .
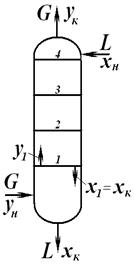
Материальный баланс колонны для всей колонны по всем компонентам
по НКК:
Доля отбора:
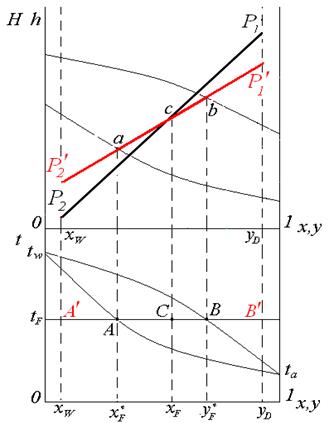
Режим минимального орошения
W ( Режим полного орошения При бесконечном флегмовом и паровом числах рабочие линии обеих частей колонны сливаются с диагональю диаграммы х-у. В этом случае, как следует из уравнения рабочей линии, составы потоков паров и жидкости, являющиеся встречными на одном уровне, для любого сечения колонны будут равны: хn+1=yn, а число тарелок будет мин и равным Nмин. Такой режим работы колонны можно представить двояко: 1.колонна работает с отбором ректификата D, остатка W и с подачей сырья F=D+W при потоках флегмы g и паров G, стремящихся к бесконечности(режим бесконечной флегмы). 2.колонна работает без отбора продуктов: D=0, W=0 и F=D+W=0, но с заданными подводом тепла QB в кипятильнике и с отводом тепла Qd в конденсаторе,т.е. в этом случае встречные потоки пара и жидкости равны и определяются теплоподводом в кипятильник(режим полного орошения). Парциальный конденсатор
Для обеспечения нормальной работы колонны необходимо на верху ее отводить определенное количество тепла для конденсации части паров и образования потока флегмы (орошения). Один из самых распространенных способов отвода тепла является парциальный конденсатор.
Этот способ заключается в том, что пары, уходящие с верхней тарелке концентрационной части колонны
Циркуляционное орошение
Для обеспечения нормальной работы колонны необходимо на верху ее отводить определенное количество тепла для конденсации части паров и образования потока флегмы (орошения). Один из самых распространенных способов отвода тепла является парциальный конденсатор. Этот способ заключается в том, что пары, уходящие с верхней тарелке концентрационной части колонны
Классификация основных процессов и аппаратов по способу создания движущей силы процессы (и аппараты) – массообменные, гидромеханические, механические, тепловые, химические. Массообменные процессы - переход вещества из одной фазы в другую за счет диффузии 1) тв→ж растворение твердых веществ; ж →тв кристаллизация; ж → ж экстракция; ж →г испарение жидкости, десорбция; г → ж конденсация паров, абсорбция; ж↔ п ректификация; тв→г возгонка, десорбция; г →тв адсорбция. Движущая сила: разность концентраций вещества между соответствующими фазами системы Скорость определяется законами массопередачи. Гидромеханические процессы связаны с переработкой суспензий Суспензия – неоднородная система, состоящая из жидкости или газов и взвешенных в них твердых или жидких частиц 1) перемещение жидкости или газа; 2) перемешивание в жидкой среде; 3) разделение жидких неоднородных систем (осаждение, фильтрование, центрифугирование); 4) очистка газов от пыли. Движущая сила: разность давлений, обусловленная разностью плотностей. Скорость определяется законами гидромеханики Механические процессы связаны с обработкой твердых тел и их перемещением 1) измельчение; 2) рассев; 3) транспортирование; 4) дозирование; 5) смешение. Движущая сила: разность сил, давлений, градиент напряжений (сдвиг, растяжение) Скорость определяется законами механики твердых тел Тепловые процессы связаны с теплообменом 1) нагревание; 2) охлаждение; 3) испарение; 4) конденсация; 5) плавление; 6) затвердевание; 7) выпаривание; 8) кристаллизация. Движущая сила: разность температур Скорость определяется законами теплопередачи Химические процессы связаны с химическими превращениями участвующих в процессе веществ и получением новых соединений 1) каталитический крекинг; 2) гидроочистка; 3) риформинг; 4) пиролиз и т.д. Движущая сила: разность концентраций реагирующих веществ Скорость определяется законами химической кинетик КЛАССИФИКАЦИЯ АППАРАТОВ
Периодические процессы Характеризуются неустановившимся состоянием во времени Работа делится на определенные циклы, в течение которых осуществляются все стадии процесса Непрерывные процессы Характеризуются установившимся режимом, не зависящим от времени Обеспечивается непрерывный подвод сырья и вывод продуктов, установившееся состояние – среднестатическое
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 2051; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.008 с.) |




 В основу классификации положен основной процесс, определяющий назначение аппарата
В основу классификации положен основной процесс, определяющий назначение аппарата
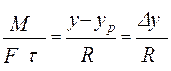


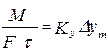 или
или 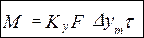 , кг
, кг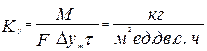
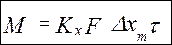


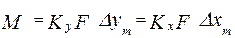 , кг/ч
, кг/ч -общий вид материального баланса.
-общий вид материального баланса.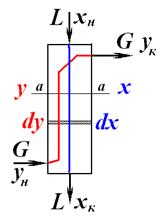 yн>yк xн< xк
yн>yк xн< xк
 уравнение материального баланса
уравнение материального баланса 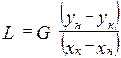 ;
;  уравнения расхода фаз
уравнения расхода фаз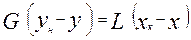
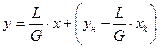 - уравнение линии концентраций(рабочей линии, оперативной линии)
- уравнение линии концентраций(рабочей линии, оперативной линии)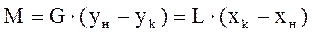 (1) – мат.баланс для всего аппарата, М –кол-во переданной массы.из урав (1) →
(1) – мат.баланс для всего аппарата, М –кол-во переданной массы.из урав (1) →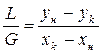 (2) – соотношение между потоками контактирующих фаз
(2) – соотношение между потоками контактирующих фаз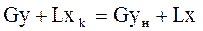 (3) – мат.баланс для сечения ниже 1-1
(3) – мат.баланс для сечения ниже 1-1 уравнение рабочей линии
уравнение рабочей линии у=L/G*x+(yн –L/G*xк) уравнение линии концентраций(раб.линии,оперативной линии)
у=L/G*x+(yн –L/G*xк) уравнение линии концентраций(раб.линии,оперативной линии) . В=yн –L/G*xк
. В=yн –L/G*xк  и в фазе L:
и в фазе L: 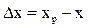 .
.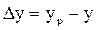 и в фазе L:
и в фазе L: 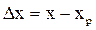 .
.

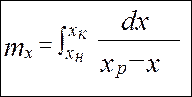
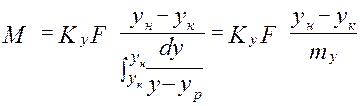
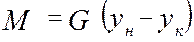 ;
; 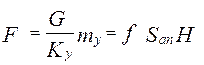
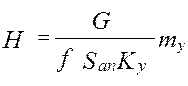 ;
; 
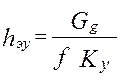 ;
; 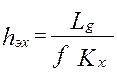 ;
; 
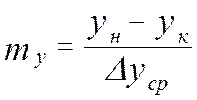
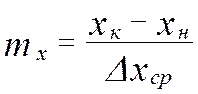
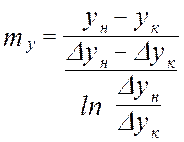
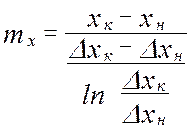

 от величины движущей силы процесса. При сближении рабочей и равновесной линии ∆ ↓ → ЧТТ ↑ и наоборот. ЧТТ используется для определения высоты контактной зоны аппарата Н, для этого используют ВЭТТ.
от величины движущей силы процесса. При сближении рабочей и равновесной линии ∆ ↓ → ЧТТ ↑ и наоборот. ЧТТ используется для определения высоты контактной зоны аппарата Н, для этого используют ВЭТТ. (1) – мат.баланс фазы G в интегральной форме
(1) – мат.баланс фазы G в интегральной форме (2) – уравнение массопередачи
(2) – уравнение массопередачи (3) - поверхность фазового контакта
(3) - поверхность фазового контакта (4) – поверхность массообмена для насадочных аппаратов, где
(4) – поверхность массообмена для насадочных аппаратов, где - раб.V аппарата*поверхность контакта фаз в 1 его V.
- раб.V аппарата*поверхность контакта фаз в 1 его V.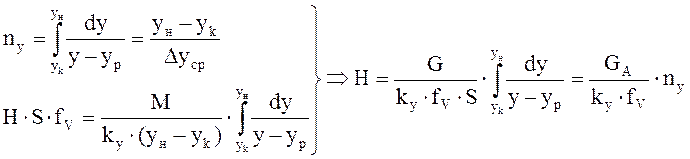 (5) – высота аппарата,
(5) – высота аппарата, -массовая скорость ф.G [
-массовая скорость ф.G [ 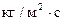 ]
] - высота, эквивалентная одной единице переноса.
- высота, эквивалентная одной единице переноса. где L – число степеней свободы n – число компонентов N – число фаз
где L – число степеней свободы n – число компонентов N – число фаз
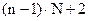 - общее число переменных, определяющих состояние системы.
- общее число переменных, определяющих состояние системы.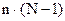 - общее число уравнений для расчета состояния системы, где (N-1) – число уравнений, достаточных для расчета концентрации компонентов, n – число переменных.
- общее число уравнений для расчета состояния системы, где (N-1) – число уравнений, достаточных для расчета концентрации компонентов, n – число переменных.


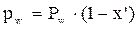


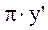 =
= 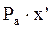 (1)
(1) =
=  (2)
(2)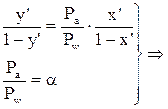 (3)
(3) - уравнение кривой равновесия фаз.
- уравнение кривой равновесия фаз.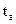 ) (1,1) и ВКК (
) (1,1) и ВКК ( ) (0,0).
) (0,0).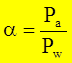 - коэффициент относительной летучести. Характеризует способность компонента переходить в паровую фазу. Чем он больше, тем легче компонент переходит. КОЛ зависит от температуры и давления, зависимость обратнопропорциональная.
- коэффициент относительной летучести. Характеризует способность компонента переходить в паровую фазу. Чем он больше, тем легче компонент переходит. КОЛ зависит от температуры и давления, зависимость обратнопропорциональная.  >1.
>1.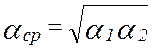
 Три способа:
Три способа:
 Многократное испарение -
Многократное испарение -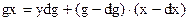 (1) – материальный баланс по НКК для элементарного процесса; где g – масса загрузки в испарители, x – концентрация в ней НКК,
(1) – материальный баланс по НКК для элементарного процесса; где g – масса загрузки в испарители, x – концентрация в ней НКК, (2) – уравнение Рейлея.
(2) – уравнение Рейлея.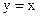 (3) – пар находится в равновесии с жидкостью.
(3) – пар находится в равновесии с жидкостью.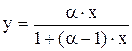 (4) – уравнение КРФ через y.
(4) – уравнение КРФ через y. - уравнение Рейлея, используется для определения
- уравнение Рейлея, используется для определения 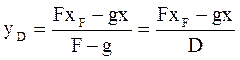 - средний состав отгона.
- средний состав отгона. Начало перегонки: g0, x0. В рассматриваемый момент: g, x
Начало перегонки: g0, x0. В рассматриваемый момент: g, x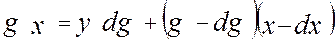

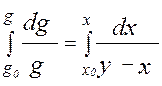


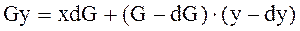 (1) – материальный баланс для бесконечно малой массы сконденсированных паров
(1) – материальный баланс для бесконечно малой массы сконденсированных паров (2) – уравнение Рейлея.
(2) – уравнение Рейлея. (4) – уравнение КРФ через x.
(4) – уравнение КРФ через x.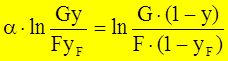 - уравнение Рейлея, используется для определения
- уравнение Рейлея, используется для определения  - средний состав конденсата.
- средний состав конденсата.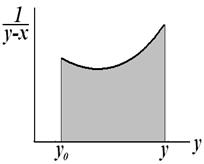



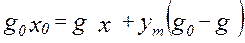



 испаритель
испаритель 

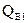

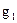

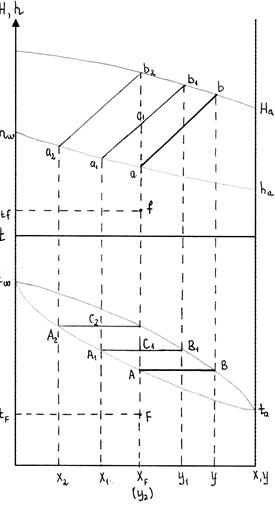
 , находящаяся при тем-ре
, находящаяся при тем-ре  и
и 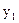 , при этом на первой ступени:
, при этом на первой ступени: 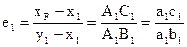 ,относ.кол-во исп.ж-и:
,относ.кол-во исп.ж-и: , масса жидкого остатка:
, масса жидкого остатка: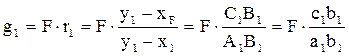 .Жидкий остаток подвергают ОИ во второй ступени при
.Жидкий остаток подвергают ОИ во второй ступени при 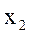 и
и  .
.  , доля неиспарившейся жидкости:
, доля неиспарившейся жидкости: 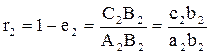 . Масса жидкого остатка:
. Масса жидкого остатка: 
 . После проведения (к) ступеней ОИ, масса жидкости:
. После проведения (к) ступеней ОИ, масса жидкости: 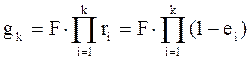 . С повышением ступеней ОИ, уменьшается масса жидкого остатка. Процесс МИ – линия
. С повышением ступеней ОИ, уменьшается масса жидкого остатка. Процесс МИ – линия  .
.
 сепаратор
сепаратор 
 от
от  - т.F (f) до
- т.F (f) до  происходит частичная конденсация.
происходит частичная конденсация. .
. → еще часть паров сконденсируется и масса остатка:
→ еще часть паров сконденсируется и масса остатка: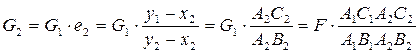
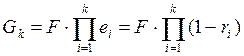 .
.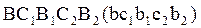
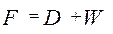



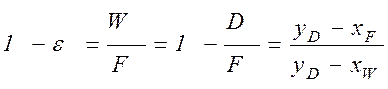
 ;
; 
 -нормальная ректификация.
-нормальная ректификация.
 -наступает момент мin орошения.
-наступает момент мin орошения.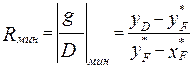

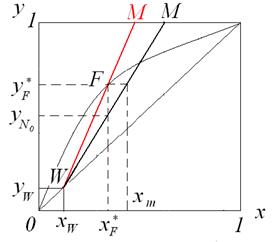
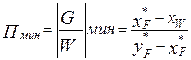 ; D(
; D(  ,
,  ) L (
) L (  ,
,  )
) ,
, 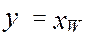 ) M(
) M(  ,
,  , y=1 )
, y=1 )
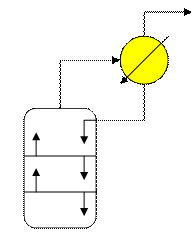
 поступают в парциальный конденсатор, где частично конденсируются. Образовавшиеся при этом поток флегмы
поступают в парциальный конденсатор, где частично конденсируются. Образовавшиеся при этом поток флегмы  возвращается на верхнюю тарелку в качестве орошения, а пары ректификата D отводятся из конденсатора. Принимается, что D и
возвращается на верхнюю тарелку в качестве орошения, а пары ректификата D отводятся из конденсатора. Принимается, что D и  - тепловой.баланс (контур 1)
- тепловой.баланс (контур 1) 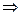

 - кол-во тепла, необходимое для охлаждения D от
- кол-во тепла, необходимое для охлаждения D от 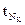 до
до  .
. 
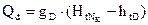
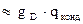 , где
, где  - скрытая теплота конденсации.
- скрытая теплота конденсации.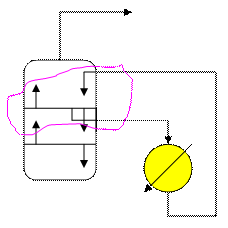 Часть флегмы
Часть флегмы  с верхней тарелки направляется в холодильник, где охлаждается и при температуре
с верхней тарелки направляется в холодильник, где охлаждается и при температуре 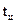 возвращается на верхнюю тарелку. Здесь флегма контактирует с парами
возвращается на верхнюю тарелку. Здесь флегма контактирует с парами  , поступающими с нижележащей тарелки при температуре
, поступающими с нижележащей тарелки при температуре  . В результате контакта паров с холодной флегмой пары охлаждаются до температуры
. В результате контакта паров с холодной флегмой пары охлаждаются до температуры 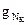 , необходимый для осуществления ректификации. С верхней тарелки уходят пары ректификата D при температуре
, необходимый для осуществления ректификации. С верхней тарелки уходят пары ректификата D при температуре 
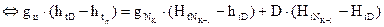 - тепловой баланс контура 1
- тепловой баланс контура 1 - масса циркуляционного орошения. ↓
- масса циркуляционного орошения. ↓ 


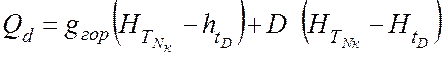

 .
. поступают в парциальный конденсатор, где частично конденсируются. Образовавшиеся при этом поток флегмы
поступают в парциальный конденсатор, где частично конденсируются. Образовавшиеся при этом поток флегмы  возвращается на верхнюю тарелку в качестве орошения, а пары ректификата D отводятся из конденсатора. Принимается, что D и
возвращается на верхнюю тарелку в качестве орошения, а пары ректификата D отводятся из конденсатора. Принимается, что D и  находятся в равновесии → ПК эквивалентен одной ТТ.
находятся в равновесии → ПК эквивалентен одной ТТ.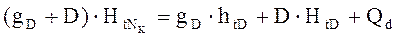 - тепловой.баланс (контур 1)
- тепловой.баланс (контур 1) 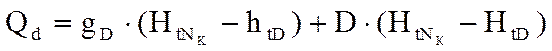
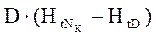 - кол-во тепла, необходимое для охлаждения D от
- кол-во тепла, необходимое для охлаждения D от 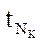 до
до 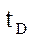 .
. 


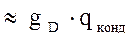 , где
, где 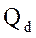 - количество тепла, отводимого в парц.конденсаторе,
- количество тепла, отводимого в парц.конденсаторе,  - скрытая теплота конденсации.
- скрытая теплота конденсации.


