
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, химические свойства.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
 1. Положение в ПСЭ – правый верхний угол от диагонали B – At. 2. Неметаллы – преимущественно p- элементы (кроме H и He – s- элементы), содержат на внешнем электронном уровне большое число электронов, прочно связанных с ядром. У типичных неметаллов электронная оболочка завершена (инертные газы) или близка к завершению (галогены, халькогены).
3. Строение простых веществ: а) Одноатомные молекулы – инертные газы (He, Ne, Ar, Kr, Xe, Rn) б) Двухатомные молекулы: O2, N2, H2, Cl2, Br2, I2, F2 – связаны неполярными ковалентными связями. в) Многоатомные молекулы: O3 – озон, P4 – белый фосфор, S8 – ромбическая сера – неполярные ковалентные связи, молекулярные кристаллические решётки. г) Полимерные молекулы: (C) n, (B) n, (Si) n – связь ковалентная неполярная, кристаллическая решётка – атомная.
4. Агрегатные состояния: Твёрдые: C, Si, B, P, S Жидкие: B2 Газообразные: H2, O2, N2, F2, Cl2 и т.д.
5. Химические свойства: С электронной точки зрения могут отдавать электроны (быть восстановителями) и принимать (быть окислителями).
Билет №10 (2) Предельные одноатомные спирты, их строение, физические и химические свойства. Получение и применение этилового спирта.  Предельные одноатомные спирты - это производные алканов, в которых один из атомов водорода заменён на гидроксильную группу Гомологический ряд: CH3OH – метанол (метиловый спирт) C2H5OH – этанол (этиловый спирт) C3H7OH – пропанол (пропиловый спирт) C4H9OH – бутанол (бутиловый спирт) Изомерия: 1. Строение углеродного скелета 2. Положение ОН-группы
Физические и химические свойства определяются строением молекулы спирта, то есть наличием ОН-групп. Атомы кислорода обладают более высокой электроотрицательностью, чем С – О и ОН в сторону атома кисдорода, таким образом на атоме кислорода образуется δ–, а на водороде δ+. СН3 → Оδ– ⟵ Нδ+
СН3− Оδ– Нδ+… Оδ–−СН3 Нδ+ Физические свойства: Из-за наличия большого количества водородных связей низшие спирты – жидкости и растворимы в воде, высшие (>12 С) нерастворимы и твёрдые. Метанол − наркотическое вещество и очень ядовит! Химические свойства определяются функциональной группой-ОН:
1) с активными металлами C2H5OH + 2Na → 2C2H5ONa + H2 2) окисление частичное O C2H5OH + CuO этанол этаналь 3) окисление полное – горение C2H5OH + 3O2 → 2CO2 + 3H2O + Q 4) реакция дегидратации (отщепление воды) C2H5OH этилен внутримолекулярное отщепление: C2H5OH + HOC2H5 диэтиловый эфир 5) взаимодействие с карбоновыми кислотами (реакция этерефикации) O O CH3−C−OH + HOC2H5 уксусная кислота этанол этилацетат Билет №11 (1) Электрохимический ряд металлов. Вытеснение металлов из растворов солей другими металлами.  Все металлы по активности расположены в электрохимическом ряду. Его впервые составил Н.Н. Бекетов ещё в XIX веке.
1) Восстановительная активность металлов уменьшается слева направо, а окислительная активность ионов слева направо увеличивается.
2) Металлы, стоящие до водородв вытесняют водород из растворов кислот (кроме азотной кислоты − HNO3).
Fe + 2HCl → FeCl2 + H2 Mg + 2HCl → MgCl2 + H2 – реакция протекает активнее Mg + 2H+ + 2Cl− → Mg2+ + 2Cl− + H2
3) Более активный металл вытесняет менее активный металл из растворов его солей
Fe + CuSO4 → FeSO4 + Cu в-ль ок-ль Fe + Cu2+ + SO42− → Fe2+ + SO42− + Cu Fe + Cu2+ → Fe2+ + Cu Fe0 – 2ē → Fe2+ |1 Cu2+ + 2ē → Cu |1
4) Более активный металл вытесняет менее активный металл из его оксида (метод алюминотермии): 6ē 2Al0 + 3Mn2+O в-ль ок-ль
Билет №11 (2) Альдегиды, их строение и свойства.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 611; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.119.140 (0.007 с.) |

 H2+1S–2
в-ль ок-ль
H2+1S–2
в-ль ок-ль
 .
. 2C2H5OH + 2CO2↑
2) гидролиз целлюлозы и последующее сбраживание глюкозы;
3) из этилена (гидратация)
CH2=CH2 + H2O
2C2H5OH + 2CO2↑
2) гидролиз целлюлозы и последующее сбраживание глюкозы;
3) из этилена (гидратация)
CH2=CH2 + H2O  C2H5OH
C2H5OH
 CH2=CH2 + H2O
CH2=CH2 + H2O C2H5OC2H5 + H2O
C2H5OC2H5 + H2O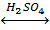 CH3−C−OC2H5 + H2O
CH3−C−OC2H5 + H2O


