
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Непредельные углеводороды ряда этилена, общая формула состава, электронное и пространственное строение, химические свойства этилена, практическое применение.
 Алкены – непредельные углеводороды, с общей формулой
CH2=CH2 CH2=CH–CH3 CH3–CH=CH–CH3 CH3=CH–CH–CH3 этилен (этен) пропилен (пропен) бутен–2 бутен–1
Двойная связь состоит из двух: прочной σ - связи (по линии соединяющей центры атомов углерода) и менее прочной π - связи (за счёт перекрывания p - орбиталей атома углерода вне σ - связи).
которые и образуют σ - связь. Часть молекулы, соединяющая π-связь, имеет плоскую структуру, а остальная – зигзагообразная. Для алкенов характерны виды изомерии (С4Н8): · ·
· цис- транс- изомерия:
· межклассовая (с циклоалканами) Химические свойства (обусловлены наличием π-связи): 1) Присоединение водорода и галогенов: СH2=СН2 + Н2 этилен этан качественная реакция на двойную связь 2) Присоединение воды: Н2С=СН2 + НОН этиловый спирт 3) Окисление: а) полное (горение) б) частичное C2H2 + 3O2 этиленгликоль Качественная реакция обесцвечивание розового раствора KMgO2 4) Реакции полимеризации: n CH2=CH2 полиэтилен
Билет №3 (1) Виды химической связи(ионная, металлическая, водородная, ковалентная - полярная, и неполярная).  Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Билет №3 (2) Аминокислоты, их строение и химические свойства. Биологическая роль аминокислот и их применение.  Аминокислоты – азотосодержащие органические соединения, содержащие аминогруппы –NH2 и карбоксильные группы –COOH.
Гомологический ряд:
Для синтеза белков представляют интерес α - аминокислоты у которых аминогруппа находится у второго атома углерода. Для аминокислот характерны реакции с участием двух функциональных групп. Химические свойства: 1) Как основание реагируют с кислотами: HOOC–CH2–NH2 + HCl основание кислота соль 2) Как кислота, реагирует со щелочами: NH2–CH2–C–OH + OHNa кислота O соль O 3) При одинаковом количестве NH2 и COOH групп раствор аминокислоты нейтрален, при неравенстве имеет кислый или основной характер. В водном растворе может образовываться биполярный ион: H2N–CH2∙COOH ⇄ H3N + –CH2–COO– биполярный ион 4) Взаимодействие аминокислот друг с другом: H2N–CH2COOH + H2NCH–COOH глицин CH3 O H CH3 Эта реакция поликонденсации (с отщеплением H2O) составляет содержание процесса синтеза белковой молекулы. Звенья, образующие молекулы белка, соединены между собой пептидными связями. Из 20 аминокислот, соединённых между собой, состоят все белковые вещества. Часть из этих аминокислот организм человека способен выработать, другую часть (незаменимые аминокислоты) он получает, используя в пищу белковые вещества (мясо, бобовые и др.)
Применение: 1) Добавки к пище; 2) Лекарственные средства (глицин); 3) Производство полиамидных материалов (капрон, нейлон); Билет №4 (1)
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 574; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.180.76 (0.007 с.) |
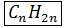 , в молекулах содержится одна двойная связь.
, в молекулах содержится одна двойная связь.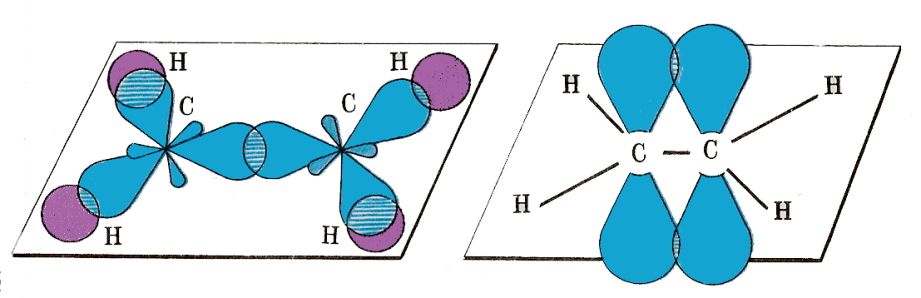 Атомы углерода, образующие двойную связь, находятся в состоянии sp2–гибридизации, три гибридные орбитали находятся в плоскости под углом 120°, а перпендикулярно к ним находятся не гибридные p - орбитали,
Атомы углерода, образующие двойную связь, находятся в состоянии sp2–гибридизации, три гибридные орбитали находятся в плоскости под углом 120°, а перпендикулярно к ним находятся не гибридные p - орбитали,
 положение двойной связи: и
положение двойной связи: и
 разветлённость скелета:
разветлённость скелета:
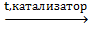 CH3–СН3 Н2С=СН2 + Br2
CH3–СН3 Н2С=СН2 + Br2  BrCH2–CH2Br
BrCH2–CH2Br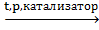 СН3–СН2–ОН
СН3–СН2–ОН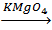 OH–СН2–СН2–OH
OH–СН2–СН2–OH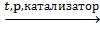 [–CH2–CH2–] n
[–CH2–CH2–] n


 NH2CH2C–ONa + H2O
NH2CH2C–ONa + H2O


