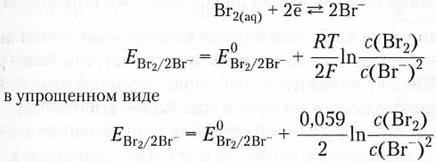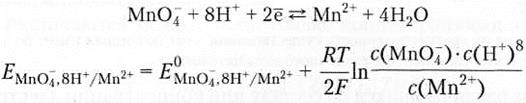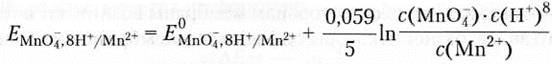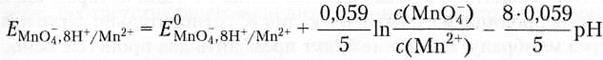Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительный потенциалСодержание книги
Поиск на нашем сайте
(редокс-потенциал). Если пластинку из инертного металла (например, платины) опустить в раствор, содержащий одновременно и окисленную, и восстановленную форму вещества, то пластинка будет выступать в качестве переносчика электронов. В растворе установится равновесие между окисленной и восстановленной формами, а на пластинке возникнет окислительно-восстановительный потенциал. Рассчитать величину этого потенциала можно с помощью уравнения Нернста — Петерса, в котором под знаком логарифма находится выражение, обратное выражению для константы равновесия процесса восстановления. Рассмотрим несколько примеров.
Пример 7.5.
Пример 7.6.
или в упрощенном виде при температуре 25°С
Преобразование этого уравнения позволяет выразить зависимость редокс-потенциала потенциала от значения pH среды:
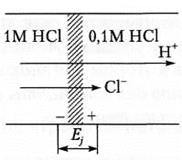
Анализируя примеры 5 и 6, можно сделать вывод о значительном влиянии среды на величину редокс-потенциала. Если в полуреакции не участвуют ионы Н+ или ОН-, то величина восстановительного потенциала не зависит от кислотности среды; если они принимают участие в процессе восстановления, то величина этого потенциала будет уменьшаться или увеличиваться с изменением pH раствора. Для характеристики биологических окислительно-восстановительных процессов используется стандартный биологический редокс-потенциал (Е°), рассчитываемый для температуры 25 или 37°С (298 или 310 К) и при pH = 7 (концентрации окисленной и восстановленной форм 1 моль/л). Понятие о диффузионном и мембранном потенциалах. Рассмотрим сосуд, в котором находятся два разных электролита или два одинаковых, но с различными концентрациями, которые разделены перегородкой. При удалении последней возникнет диффузионный потенциал (Ед) — разность потенциалов между слоями жидкости, возникающая в результате различных скоростей диффузии катионов и анионов (пример — рис. 1).
Рис. 7.1. Механизм возникновения диффузионного потенциала. Если скорость движения катионов больше скорости движения анионов (а именно это чаще наблюдается в жидкостях организма), то в более разбавленном растворе возникает положительный заряд, и жидкость в этой области заряжается положительно, в то время как более концентрированная часть раствора оказывается заряженной отрицательно. Положительный заряд начинает тормозить движение катионов и ускорять движение анионов. Через некоторое время скорости движения ионов сравниваются и потенциал исчезает.
|
|||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 85; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.152.123 (0.006 с.) |