Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первый закон термодинамики .
Внутренняя энергия системы (U) в результате какого-либо процесса (в том числе и химического) может изменяться на величину ∆ U. Передача энергии системе или от нее может происходить в форме теплоты Q и (или) работы А. Эти величины связаны между собой следующим уравнением: Q = ∆ U + А, где Q — теплота, поглощенная системой; ∆ U — изменение внутренней энергии системы; А — работа, совершаемая системой. Это математическое выражение носит название первого закона термодинамики: Поглощенная системой теплота расходуется на изменение внутренней энергии системы и на совершение ею работы против внешних сил. По сути, первый закон термодинамики является не чем иным, как одной из формулировок закона сохранения энергии, в соответствии с которым энергия, потерянная системой, равна энергии, приобретенной внешней средой, или энергия, приобретенная системой, равна энергии, потерянной внешней средой. Энергия не может быть создана или уничтожена, а может лишь переходить из одной формы в другую (Р. Майер, 1842; Д. Джоуль, 1842; Г. Гельмгольц, 1847). Если работа связана только с изменением объема системы при постоянном давлении, подстановка уравнения приводит к соотношению ∆ U = Q – p ∆ V. В изохорных процессах (реакции, проходящие без изменения объема системы ∆ V = 0) теплота, подведенная к системе, расходуется только на увеличение ее внутренней энергии: ∆ U = QV, где QV — теплота, поглощаемая при постоянном объеме. Чаще всего химические реакции проводят в открытых сосудах, например: в пробирках, химических стаканах, химических реакторах, сообщающихся с окружающей средой. В этом случае давление в системе остается постоянным и совпадает с атмосферным — это так называемые изобарные процессы (реакции, проходящие при постоянном давлении): Qp = ∆U – А где Qр — теплота процесса при неизменном давлении Подставив, получим, Qp = ∆U + p∆V. Изменение энтальпии в процессе при постоянном давлении равно ∆Н = ∆U + p∆V. Сравнивая эти уравнения, получим ∆Н = Qp Таким образом, теплота, подведенная к системе в условиях изобарного процесса, расходуется только на увеличение ее энтальпии.
Термохимия. Раздел химии, занимающийся изучением тепловых эффектов, наблюдаемых при протекании химических реакций, называется термохимией.
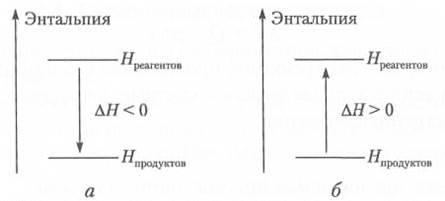
Тепловой эффект — количество теплоты, выделяющееся или поглощающееся при протекании физико-химического процесса, если: а) процесс протекает при р = const или V = const; б) в системе совершается только работа расширения; в) температура исходных веществ и продуктов реакции одинакова. Экзотермическим называют процесс, сопровождающийся выделением теплоты, эндотермическим — процесс, сопровождающийся поглощением теплоты. Если процесс протекает при постоянном давлении, то тепловой эффект представляет собой изменение энтальпии системы: ∆Н = ∆Н прод - ∆Н реаг. Если ∆Н < 0 — это экзотермический процесс, ∆Н > 0 — эндотермический процесс (рис. 4.3). Если процесс не сопровождается изменением объема, тепловой эффект процесса равен изменению внутренней энергии системы ∆ U. Если ∆ U < 0 - экзотермический процесс, ∆ U > 0 — эндотермический процесс.
Рис. 2.3. Экзотермическая ( а ) и эндотермическая (б) реакции Термохимические уравнения реакции — уравнения реакции, в которых помимо формул исходных веществ и продуктов (с соответствующими стехиометрическими коэффициентами) указаны их агрегатные состояния и отвечающий этой реакции тепловой эффект (изменение энтальпии), на пример: 0,5N2(г.) + 1,5Н2(г.) = NH3(г.) + 46,2 кДж (термохимическая форма записи) или 0,5N2(г.) + 1,5Н2(г.) = NH3(г.); ∆Н = -46,2 кДж/моль. (термодинамическая форма записи) Рассмотрим стандартные изменения энтальпии. Изменения энтальпии в ходе химической реакции зависят от температуры, давления и физического состояния веществ, участвующих в процессе. Величина ∆Н зависит также от количества этих веществ. Поэтому изменение энтальпии может быть характеристической величиной лишь в случае, если ее измерение проводится при определенных условиях, называемых стандартными. Стандартные условия: · все вещества являются химически чистыми и соответствуют приводимой химической формуле; · твердые и жидкие вещества находятся в устойчивых для данных условий агрегатных состояниях и аллотропных модификациях; · количества веществ равны 1 моль или вещества в растворе содержатся в количествах 1моль на 1000 г растворителя;
· давление постоянно и равно 101,3 кПа, или 1 атм (ИЮПАК рекомендует использовать точное значение 100 кПа); · температура постоянна и может иметь любое значение, но обычно выбирается равной 25°С (298 К). На практике, особенно применительно к разбавленным водным растворам, каковыми являются физиологические жидкости, используют молярные концентрации. В этом случае стандартное состояние соответствует концентрациям растворенных веществ 1 моль/л. Стандартная энтальпия образования (∆ f H 0 298) — это тепловой эффект реакции образования 1 моль какого-либо вещества из простых веществ в стандартных условиях при 298К. Стандартная энтальпия образования простого вещества в наиболее устойчивой аллотропной модификации равна нулю. Стандартная энтальпия образования аммиака соответствует тепловому эффекту реакции 1,5Н2(г) + 0,5N2(г) = NH3(г) + 45,94 кДж при постоянном давлении (298 К) ∆ f H 0 298 = -45,94 кДж/моль. Энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, по сравнению с энтальпиями образования газов. Стандартная энтальпия сгорания (∆с H 0 298) — это тепловой эффект реакции сгорания в избытке кислорода 1 моль вещества в его стандартном состоянии при температуре 298 К и давлении 101,3 кПа (1 атм). Стандартная энтальпия сгорания этилового спирта соответствует тепловому эффекту реакции С2Н5ОН(ж) + 3,5О2(г) = 2СО2(г) + 3Н2О(ж) + 1638 кДж при постоянном давлении (298 К) ∆с H 0 298 = -1638 кДж/моль. Стандартные энтальпии образования и стандартные энтальпии сгорания различных веществ сведены в соответствующие таблицы, которые имеются в справочной литературе. Стандартная энтальпия реакции (∆ r H 0 298) это изменение энтальпии при 298К в стандартных условиях в расчете на количества веществ, соответствующие стехиометрическим коэффициентам. Калориметрия — совокупность экспериментальных методов измерения тепловых эффектов, сопровождающих различные физико-химические и биологические процессы. Калориметр — изолированный сосуд для измерения количества теплоты, высвобождаемой или поглощаемой в результате химической реакции или фазового превращения (рис. 2.4).
Рис. 2.4. Схема калориметра Суть эксперимента состоит в измерении изменения температуры реакционной смеси в результате химического или иного превращения. В некоторых случаях изменение температуры определяется в охлаждающей реакционный сосуд жидкости, например воде. Калориметр представляет собой прочный закрывающийся сосуд, окруженный теплоизолирующей водяной рубашкой. Образец известной массы помещается внутри бомбы в атмосфере чистого кислорода под давлением 25 атм. Затем образец поджигают с помощью электрической искры. За счет выделяющейся при горении энергии происходит нагрев водяной рубашки. Поскольку сгорание вещества в калориметрической бомбе происходит при постоянном объеме, выделяющая тепловая энергия численно равна изменению внутренней энергии U. Выделяемая в ходе эксперимента энергия может быть рассчитана и следующему уравнению: Q = (С сосуд + m ∙ C содерж) ∆ T где Q — энергия, передаваемая в форме тепла сосуду и его содержимом; С сосуд — теплоемкость сосуда; т — масса содержимого сосуда (вода или реакционная смесь); С содерж — удельная теплоемкость содержимого; ∆ T — измеренное изменение температуры содержимого сосуда.
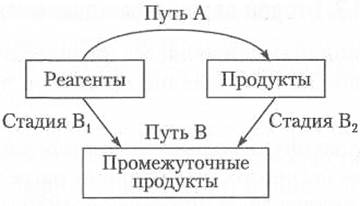
Энтальпии реакций, которые невозможно провести в лабораторных условиях, могут быть вычислены по известным энтальпиям других реакций. Основной закон термохимии — закон Гесса (закон постоянства сумм теплот реакции): тепловой эффект реакции не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы. Таким образом, если какую-либо реакцию теоретически представить в виде определенного числа последовательных стадий, то изменение энтальпии реакции будет равно сумме изменений энтальпий на каждой стадии (рис. 2.5) ∆ НА = ∆ НВ = ∆ HBl + ∆НВ 2.
Рис. 2.5. Стадии реакции
Несмотря на то, что закон Гесса был установлен опытным путем, он непосредственно вытекает из свойств функций состояния системы: внутренняя энергия U и энтальпия H являются функциями состояния системы, следовательно, их изменение ∆ U и ∆Н не зависит от пути процесса, а равно разности ∆ U = U 2 – U 1; ∆Н = H 2 – H 1 между значениями U 2 и Н2 в конечном состоянии и значениями U 1 и Н1 в начальном состоянии системы. Следствия из закона Гесса. 1. Тепловой эффект химической реакции (∆ r H 0) равен разности между суммой теплот образования продуктов реакции (∑∆ f H 0 прод) и суммой теплот образования исходных веществ (∑∆ f H 0 реаг) с учетом их стехиометрических коэффициентов. Для теплового эффекта реакции, проводимой при постоянном давлении ∆ r H 0 = ∑ ν j ∆ f H 0 прод - ∑ ν i ∆ f H 0 реаг. Пример 2.1. Рассчитаем тепловой эффект реакции образования мочевины (одного из важнейших продуктов жизнедеятельности организма) из аммиака и диоксида углерода: 2NH3(r) + СО2(г) = CO(NH3)2(k) + Н2О(ж) ∑∆ fH 0 -45,94 -393,51 -333,1 -241,83 ∆ r H 0 = (-333,1 – 241,83) - (-45,94∙2 – 393,51) = -88,54 кДж. 2. Тепловой эффект химической реакции (∆ r H 0) равен разности между суммой теплот сгорания исходных веществ (∑∆ C H 0 реаг) и суммой теплот сгорания продуктов реакции (∑∆ C H 0 прод) с учетом их стехиометрических коэффициентов: ∆ r H 0 = ∑ ν j ∆ C H 0 реаг - ∑ ν i ∆ C H 0 прод. Пример 2.2. Рассчитаем тепловой эффект реакции молочнокислого брожения глюкозы, зная, что стандартные теплоты сгорания глюкозы и молочной кислоты равны -2810 и -1344 кДж/моль соответственно: С6Н12O6 → 2СН3СН(ОН)СООН
∑∆ CH 0 -2811 -1344 ∆ r H 0 = -2811 - (-1344∙2) = -123 кДж. 3. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
|
||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 40; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.171.121 (0.028 с.) |