
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения состава раствора
Значение растворов в жизнедеятельности организмов. Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Учение о растворах представляет для медиков особый интерес потому, что важнейшие биологические жидкости — кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Биожидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т. д.). Плазма крови является средой для клеток — лимфоцитов, эритроцитов, тромбоцитов. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ. Такое постоянство называется концентрационным гомеостазом. Вода как растворитель. Самым распространенным растворителем на нашей планете является вода. Тело среднего человека массой 70 кг содержит примерно 40 кг воды. У животных и растительных организмов вода составляет обычно более 50 %, а в ряде случаев содержание воды достигает 90—95%.
Вследствие своих аномальных свойств вода — уникальный растворитель, прекрасно приспособленный для жизнедеятельности. Прежде всего, вода хорошо растворяет ионные и многие полярные соединения. Такое свойство воды связано в значительной мере с ее высокой диэлектрической проницаемостью (ε = 78,5). Поскольку силы притяжения между ионами, согласно закону Кулона, меняются обратно пропорционально величине ε, притяжение между ионами уменьшается примерно в восемьдесят раз при растворении ионных соединений в воде. В результате многие ионные соединения диссоциируют и отличаются высокой растворимостью в воде.
Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Рис. 4.2. Строение молекулы воды: а) с указанием распределения зарядов на атомах, б) схематическое. Молекула воды (рис. 4.2.) образуется из двух атомов водорода и атома кислорода. Угол между связями составляет 104,5°. В результате асимметрии в распределении электронов вокруг атома кислорода центр отрицательного электрического заряда (неподеленной пары) электронного облака не совпадает с центром положительного заряда атома кислорода. Это приводит к появлению большого электрического дипольного момента молекулы воды, определяющего ее полярные свойства и хорошую растворимость полярных и низкую растворимость неполярных веществ в воде. Для воды характерно наличие ассоциатов — групп молекул, соединенных водородными связями. В зависимости от сродства к воде функциональные группы растворяемых частиц подразделяются на гидрофильные (притягивающие воду), легко сольватируемые водой, гидрофобные (отталкивающие воду) и дифильные.
К гидрофильным группам относятся полярные функциональные группы: —ОН, —NH2, —SН, —СООН. К гидрофобным — неполярные группы, например углеводородные радикалы: СН3—(СН2)n—, С6Н5—. К дифильным относят вещества (аминокислоты, белки, нуклеиновые кислоты), молекулы которых содержат как гидрофильные группы, так и гидрофобные группы.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 38; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.71.237 (0.005 с.) |

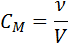
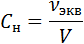
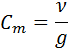

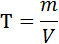

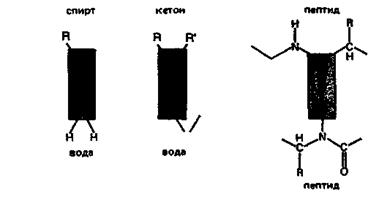 Другой многочисленный класс веществ, хорошо растворимых в воде, включает такие полярные органические соединения, как сахара, альдегиды, кетоны, спирты. Их растворимость в воде объясняется склонностью молекул воды к образованию полярных связей с полярными функциональными группами этих веществ, например, с гидроксильными группами спиртов и сахаров или с атомом кислорода карбонильной группы альдегидов и кетонов. Вследствие высокой полярности вода вызывает гидролиз веществ.
Другой многочисленный класс веществ, хорошо растворимых в воде, включает такие полярные органические соединения, как сахара, альдегиды, кетоны, спирты. Их растворимость в воде объясняется склонностью молекул воды к образованию полярных связей с полярными функциональными группами этих веществ, например, с гидроксильными группами спиртов и сахаров или с атомом кислорода карбонильной группы альдегидов и кетонов. Вследствие высокой полярности вода вызывает гидролиз веществ.



