Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Второй закон термодинамики .Содержание книги
Поиск на нашем сайте
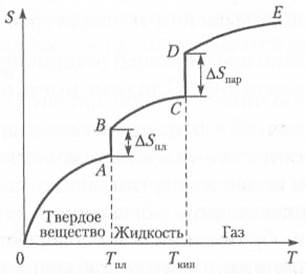
Второй закон термодинамики является физическим принципом, накладывающим ограничение на направление процессов передачи тепла меж; телами. Согласно этому закону невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому (одна из первых формулировок закона; М. В. Ломоносов, 1850 г.). Существует несколько эквивалентных формулировок второго закона термодинамики, среди которых: • постулат Клаузиуса: «Невозможно осуществить перенос тепла от более холодного тела к более горячему без затраты работы»; • постулат Томсона: «Невозможно превратить какое-либо количество теплоты полностью в работу без того, чтобы часть теплоты не оказалась растраченной при более низкой температуре». Энтропия (S) — важная функция состояния термодинамичесм системы. Энтропию можно охарактеризовать как меру хаотичности или неупорядоченности системы. S = k ∙ lnW, где W — число возможных микросостояний системы; k — постоянная Больцмана, равная отношению R / NA = 1,381•10-23 Дж/К; R — универсальная газовая постоянная, равная 8,315Дж/моль∙К); NA — постоянная Авогадро, равная 6,022•1023 моль-1. При абсолютном нуле (Т = 0К) энтропия идеального кристалла равна нулю — полная упорядоченность, W = 1 (иногда это положение называется нулевым законом термодинамики). Изменение энтропии (S) равно теплоте, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется этот процесс ∆ S = Q/T. Для необратимого процесса при температуре Т: ∆S > Q/Т В соответствии с изменением числа возможных микросостояний системы энтропия (S): · возрастает при превращении жидкости или твердого тела в газ; · увеличивается при растворении твердого вещества или жидкости в воде или в другом растворителе; · уменьшается при растворении газа в воде или в другом растворителе; · возрастает при увеличении числа частиц в системе; · имеет меньшие значения в ковалентно связанных твердых веществах с прочными, пространственно направленными связями, по сравнению с кристаллами с частично металлической связью; · повышается по мере ослабления связей между атомами. На рис. 2.6 приведена типичная кривая изменения значений энтропии для вещества в широком диапазоне температур, в котором это вещество переходит из твердого кристаллического состояния в жидкое и далее из жидкого состояния в газообразное.
Рис. 2.6. Типичная зависимость энтропии вещества от температуры Повышение температуры сопровождается ростом энтропии, которая вплоть до достижения температуры плавления кристаллического вещества (Тпл) изменяется по плавной кривой ОА (см. рис. 2.6). В точке плавления нарушается дальний порядок во взаимном расположении частиц, и энтропия скачкообразно возрастает на ∆ S (отрезок АВ). Повышение температуры выше точки плавления вещества вызывает последовательное увеличение энтропии жидкости, которое происходит по плавной кривой ВС вплоть до достижения температуры кипения (Т кип). В этой точке жидкость полностью превращается в пар, и энтропия скачком возрастает на величину ∆ S пар, соответствующую отрезку CD. Далее энтропия газа изменяется по плавной кривой DE, и новое скачкообразное возрастание энтропии может произойти только в результате химических изменений газа (термической диссоциации, ионизации и т.п.), приводящих к увеличению числа частиц и росту беспорядка в системе. Энтропия 1 моль вещества в стандартном состоянии называется стандартной энтропией (S °, Дж/(моль∙К). Изменение стандартной энтропии в химической реакции, аналогично изменению энтальпии, можно определить по уравнению ∆rS° = ∑ ν j S° прод - ∑ ν i S° реаг. Пример 2.3. Рассчитаем изменение энтропии при получении сульфата цинка путем обжига сульфида цинка (сфалерита). ZnS(k) + 2O2(г) = ZnSO4(k) S ° 298, Дж/(моль-К) 57,7 205,15 110,6 ∆ r S ° = 110,6 – (57,7 + 2∙205,15) = -357,4 Дж/К. Значения стандартной молярной энтропии различных веществ при 298К сведены в таблицы и имеются в справочной литературе. Стандартная молярная энтропия простого вещества не равна нулю. Стандартная молярная энтропия сложного вещества возрастает при увеличении числа атомов в молекуле.
Свободная энергия Гиббса Для того чтобы судить о возможности самопроизвольного (без затраты энергии извне) протекания реакции, необходимо учитывать два фактора – энергию и энтропию. 1. Энергия. Все материальные системы имеют общую тенденцию к достижению минимума потенциальной энергии. В процессе химической реакции при постоянном давлении изменение энергии соответствует изменению энтальпии. В экзотермической реакции система теряет энергию в виде теплоты до тех пор, пока ее полная энтальпия не достигнет минимума.
2. Энтропия. Все материальные системы стремятся к достижению максимального беспорядка (увеличение энтропии). Учесть одновременно влияние обоих этих факторов позволяет новая термодинамическая функция состояния — энергия Гиббса или ее изменение ∆ G = ∆ Н – T∙ ∆ S. Это уравнение носит название уравнения Гиббса. Таким образом, изменение величины ∆ G учитывает изменение энтальпии и энтропии реакционной системы. Энтропийный член (T ∆ S) включает абсолютную температуру, которая позволяет учесть разупорядочивание материальной системы при повышении температуры. Для самопроизвольно протекающей реакции при постоянных температуре и давлении изменение ∆ G должно иметь отрицательное значение. Процессы, для которых ∆ G< 0, называются экзэргоническими, а для которых ∆ G > 0 — эндэргоническими. Эндэргонические процессы могут осуществляться только при подводе энергии извне. Стандартная свободная энергия образования — это изменение свободной энергии Гиббса при образовании 1 моль вещества из простых веществ в их стандартных состояниях; это тоже табличная величина, имеющаяся в справочниках. Значение свободной энергии образования ∆ f G ° измеряется в килоджоулях на моль. Стандартное изменение энергии Гиббса реакции можно вычислить, зная свободные энергии образования (∆ f G °298) продуктов и реагентов: ∆ r G ° = ∑ ν j ∆ f G 0 прод - ∑ ν i ∆ f G 0 реаг. Пример 2.4. Необходимо оценить возможность образования этилового эфира уксусной кислоты в результате реакции этерификации: С2Н5ОН(ж) + СН3СООН(ж) → СН3СООС2Н5(ж) + Н2О(ж) ∆ f G °298, кДж/моль -174,8 -390,2 -333,7 -237,14 ∆ r G ° = -333,7 + (-237,14) – (-174,8) – (-390,2) = -5,8 кДж. Поскольку изменение энергии Гиббса отрицательно, самопроизвольный процесс возможен в стандартных условиях, т.е. когда количества всех четырех соединений в правой и левой частях уравнения реакции равны 1 моль. Таблица 2.1
|
||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 45; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.240.219 (0.01 с.) |