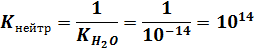Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация кислот, оснований и солей в водных растворах
Сильные кислоты диссоциируют практически полностью и необратимо: НСl → Н+ + Сl- или H2SO4 → 2H+ + SO42- Расчет pH в растворах сильных кислот: 1) для одноосновных кислот [Н+] = Скислоты; рН = -lg[H+] = -lg C; 2) для серной кислоты [Н+] = 2 Скислоты; рН = -lg[H+] = -lg2 C. Пример. Рассчитайте pH в 0,1М растворе НСl. рН = -lg[H+] = -lg CHCl = -lg 0,1 = 1,0. Диссоциация слабых кислот протекает обратимо. Сила кислоты характеризуется величиной константы кислотности (Ка) или ее отрицательным логарифмом (р Ка). НА D Н+ + А-; Ка = [H+][A-]/[НА]; р Ка = -lg Ка. Многоосновные кислоты диссоциируют ступенчато (исключение составляет серная кислота в разбавленном растворе). Так, в водном растворе трехосновной ортофосфорной кислоты наряду с молекулами Н3РO4 имеются ионы (в порядке уменьшения их количества) Н2РO4-, НРО42-, РО43-:
Расчет pH в растворах слабых кислот осуществляется следующим образом. Поскольку в результате диссоциации слабой кислоты НА D Н+ + А- в растворе образуется равное количество катионов и анионов [Н+] = [А-], а количество продиссоциировавших молекул пренебрежимо мало по сравнению с оставшимися неизменными [НА] = Скислоты - [Н+] ≈ Скислоты, следовательно
Отсюда [Н+] = После преобразования получаем рН = ½ (p Ka – lg C). При расчете pH растворов многоосновных кислот (кроме серной) в эту формулу подставляют только рКа1, так как диссоциация по второй и последующим ступеням практически не влияет на pH. Сильные основания диссоциируют практически полностью и необратимо. NaOH(ж) → Na+ + ОН-; Ва(ОН)2 → Ва2+ + 2ОН- Расчет pH в растворах сильных оснований: 1) для однокислотных оснований рОН = -lg[OH-] = -lg C; pH = 14 – рОН; 2) для двухкислотных оснований рОН = -lg[OH-] = -lg2 C; pH = 14 – рОН. Диссоциация слабых оснований протекает обратимо. Сила основания характеризуется величиной константы основности (Кв) или ее отрицательным логарифмом (p К b). В практике чаще используют константы кислотности кислоты, сопряженной данному основанию (K(BH+)), или ее отрицательный логарифм (рК(BH+)). В + Н2O D ВН+ + ОН-; р К b = -lg К b, ВН+ D В + Н+ p K (BH+) = -lg К (ВН+). В результате преобразования получаем р К b = 14 – p K (BH+). Слабые многокислотные основания диссоциируют ступенчато. Аналогично кислотам каждая последующая ступень характеризуется меньшей степенью диссоциации и меньшей константой основности К b.
Fe(OH)3 D Fe(OH)2+ + ОН- α1, К b1; Fe(OH)2+ D Fe(OH)2+ + ОН- α2, К b2; Fe(OH)2+ D Fe3+ + ОН- α3, К b3; α1 >> α2 >> α3; К b 1 >> К b 2 >> К b 3. Расчет pH в растворах слабых оснований осуществляется следующим образом. В растворе однокислотного слабого основания В с концентрацией С [ОН-] = [ВН+] [В] = C - [ВН+] ≈ C;
Отсюда [OН-] = После преобразования получаем рOН = ½ (p K b – lg C B); pH = 14 – pOH = 14 – ½(p Kb – lg CB). pH = ½(14 + p K (BH+) + lg CB) Для многокислотных оснований расчет pH не имеет смысла, так как все они практически нерастворимы в воде. Амфотерные электролиты (амфолиты) — электролиты, при диссоциации которых образуются и катионы водорода, и гидроксид-ионы. К ним относятся Н2O, Zn(OH)2, Аl(ОН)3, Сr(ОН)3 и ряд других. Диссоциация амфотерного Zn(OH)2 протекает в соответствии с уравнением 2OН- + Zn2+ + 2Н2O D Zn(OH)2 + 2Н2О или при избытке щелочи [Zn(OH)4]2- + 2Н+ Соли. Практически все соли являются сильными электролитами (исключение составляют, например, соли Сu1+ и Hg+1). Средние соли — электролиты, при диссоциации которых образуются катионы металлов или катион аммония (NH4+) и анионы кислотных остатков: (NH4)2SO4 D 2NH4+ + SO42-; Na3PO4 D 3Na+ + PO43-. Кислые и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода: KHSO3 D К+ + HSO3- — первая ступень диссоциации (необратимая); HSO3- D Н+ + SO32- — вторая ступень диссоциации (обратимая). У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы: Mg(OH)Cl D Mg(OH)+ + Сl- — первая ступень (необратимая); Mg(OH)+ D Mg2+ + ОН- — вторая ступень (обратимая). Реакция нейтрализации Из протолитической теории Брёнстеда — Лоури следует, что чем сильнее основание, тем слабее сопряженная с ним кислота, и наоборот. Рассмотрим этот вывод на примере реакции нейтрализации. Реакция нейтрализации — это реакция, протекающая между растворами кислоты и основания. Рассмотрим процесс нейтрализации слабой кислоты слабым основанием: CH3COOH + NH3 D CH3COO- + NH4+ Количественной характеристикой этого процесса является константа нейтрализации
Умножив и числитель, и знаменатель дроби на [Н+], получим
Таким образом, глубина протекания реакции нейтрализации определяется соотношением по силе исходной и образующейся кислот.
Нейтрализация сильной кислоты сильным основанием выражается уравнением Н+ + ОН- D Н2O и представляет собой реакцию, обратную самоионизации воды. Поскольку в стандартных условиях K(H2O) равна 1,0 10-14, то константа нейтрализации равна
Таким образом, в стандартных условиях реакции между сильными кислотами и основаниями можно считать практически необратимыми. Реакции гидролиза солей Гидролиз солей относится к обменным реакциям, в которых одним из реагентов является вода. Суть гидролиза заключается во взаимодействии аниона слабой кислоты или катиона слабого основания с молекулами воды. Отсюда следует, что гидролизу подвергаются не растворенные соли, а лишь определенные ионы, входящие в их состав. Эти ионы должны соответствовать или слабым кислотам, или слабым основаниям Брёнстеда.
|
||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 27; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.85.76 (0.008 с.) |


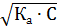 .
.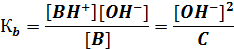
 .
.