Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы химической термодинамикиСодержание книги
Поиск на нашем сайте В результате изучения содержания этой главы студент должен: Знать • разновидности термодинамических систем, термодинамических параметре: и функций состояния, суть понятий теплоемкости, экзо- и эндотермических, экзо- и эндоэргонических процессов; • сущность понятий стандартного состояния вещества, стандартных теплотой образования и сгорания; • первое и второе начало термодинамики; • основной закон термохимии — закон Гесса и следствия из него; • критерии возможности самопроизвольного протекания процесса; Уметь • рассчитывать изменения термодинамических функций состояния систем: в стандартных условиях по табличным данным; • определять стандартную теплоту процесса по результатам калориметрического эксперимента; • оценивать возможность самопроизвольного протекания процесса в изолированных системах; Владеть • способами расчета тепловых эффектов химических реакций, изменения энтропии и энергии Гиббса; • методом определения стандартной энтальпии реакции опытным путем; • техникой выполнения химических экспериментов; • навыками работы с химическим оборудованием и реактивами. Основные понятия термодинамики. Термодинамика — это наука об энергетических свойствах объектов, состоящих из очень большого числа частиц, в различных энергетических состояниях и их изменениях в результате процессов, в которых эти объекты участвуют. Термодинамику (от греч. therme — теплота, dinamis — сила) рассматривают как науку, изучающую взаимопревращения различных видов энергий. Предмет химической термодинамики состоит в изучении превращений различных форм энергии при протекании химических реакций и способности химических систем выполнять полезную работу. Фундаментальные положения химической термодинамики могут быть использованы для: • предсказания принципиальной возможности протекания химически реакции; • предсказания направления самопроизвольного протекания процесса до достижения равновесного состояния; • определения количества энергии, теоретически необходимого для проведения реакции, или количества энергии, выделяющегося при ее самопроизвольном протекании. Основным объектом изучения термодинамики является термодинамическая система. Термодинамическая система — любая достаточно большая совокупность объектов, отделенная от окружающей среды реальной или воображаемой граничной поверхностью. В соответствии с данным определением к термодинамической системе можно отнести живую клетку, химический реактор (рис. 2.1), человека и т.п.
Рис. 2.1. Примеры термодинамической системы: живая клетка (а), химический реактор ( б ) Окружение или окружающая среда — это часть материального мира за пределами условно выделенной из него термодинамической системы. Окружение включает все остальные объекты, которые могут оказывать влияние на исследуемую систему. По характеру взаимодействия с внешней средой различают изолированные, закрытые и открытые термодинамические системы (рис. 2.2).
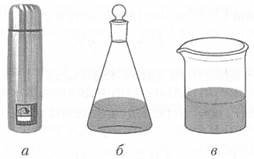
Рис. 2.2. Примеры термодинамических систем: изолированной (а), закрытой (б) и открытой (в) Изолированная система — система, не обменивающаяся с окружающей средой ни энергией (теплотой или работой), ни веществом. Несмотря на невозможность ее практического воплощения, понятие изолированной системы позволяет сформулировать основные законы термодинамики. Закрытая система — система, способная обмениваться с окружающей средой энергией, но не веществом. Открытая система — система, способная обмениваться с окружающей средой и энергией, и веществом. Система может состоять из одной фазы (гомогенная система) или нескольких фаз (гетерогенная система). Фазой называется совокупность однородных по составу и физико-химическим свойствам частей системы, отделенных от других частей системы поверхностью раздела. Важно отметить, что свойства системы при переходе через поверхность раздела фаз изменяются скачкообразно. Состояние системы определяется совокупностью физико-химических свойств (термодинамических параметров и термодинамических функций), которыми она характеризуется в данный момент времени. Термодинамические параметры (измеряемые величины) подразделяют на · экстенсивные, которые прямо пропорциональны количеству вещества системы, т.е. складываются при объединении систем (масса, объем, площадь поверхности и т.п.), · и интенсивные, которые не зависят от количества вещества системы и выравниваются при объединении систем (давление, температура, концентрация). Термодинамические функции (неизмеряемые величины) зависят от термодинамических параметров системы. Среди них выделяют следующие функции. Функции состояния, зависящие только от состояния, в котором находится система, и не зависящие от пути, по которому система пришла к данному состоянию (например, внутренняя энергия и энтальпия). Функции перехода, зависящие от пути, по которому система перешла из одного состояния в другое (например, теплота и работа). Внутренняя энергия системы (U, Дж) определяется всеми видами движений и взаимодействий, составляющих систему элементарных частиц, молекул, атомов и ионов, а именно: энергией поступательного, колебательной и вращательного движений, энергией электромагнитного, гравитационной и других силовых взаимодействий. Во внутреннюю энергию не включаются кинетическая и потенциальная энергии, характеризующие всю систем как единое целое (перемещение всей системы в окружающей среде и взаимодействие с внешними силовыми полями). Абсолютное значение внутренней энергии определить невозможно, так как нам неизвестны все возможные виды взаимодействий внутри системы. Однако можно определит ее изменение (∆ U) при переходе системы из начального состояния (1) в конечное (2): ∆U = U 2 - Uv Энтальпия системы (Н, Дж) определяется соотношением Н = U + pV, где U — внутренняя энергия; р — давление; V — объем системы. Абсолютное значение энтальпии определить также невозможно; определяют ее изменение (∆Н) при переходе системы из начального состояния (1) в конечное (2): ∆Н = Н 2 – Н1. Теплота, энергия и работа. Передача энергии от одной системы к другой осуществляется в форме теплоты или работы. Теплота и работа не являются функциями состояния системы и зависят от пути протекания процесса. Изменение внутренней энергии системы (∆ U) связано либо с переносом теплоты (Q), либо с совершением работы (А), поэтому все три функции выражаются в одних единицах — Дж (Дж = Н•м = кг•м2•с-2; 1 кал = 4,184 Дж). Работа — одна из форм передачи энергии путем преодоления сил, действующих на систему со стороны окружающих тел или наоборот. Работа, совершаемая системой против внешних сил, считается положительной (А > 0), а работа, совершаемая над системой, — отрицательной (А< 0). Система выполняет работу, если она действует с некоторой силой, направленной на преодоление сопротивления. Величина произведенной работы равна произведению силы и расстояния, на котором эта сила преодолевает сопротивление. Работа, с которой чаще всего приходится иметь дело в химии, обусловлена изменением объема системы. Такое изменение происходит, например, при выделении газа в результате химического превращения при постоянном давлении. В этом случае работа А, выполняемая системой, может быть рассчитана по уравнению А = p∆V, где р — внешнее давление; ∆V — изменение объема системы. Теплотой называется способ передачи энергии посредством хаотического движения молекул. Последнее носит название теплового движения. Количество энергии, передаваемой таким образом, обозначается Q. Теплота, полученная системой от окружающей среды, считается положительной (Q > 0), а теплота, отданная системой, — отрицательной (Q < 0). Количество переданной теплоты пропорционально массе т системы и изменению температуры, происходящему вследствие передачи энергии: Q ~ m ∆Т. Удельная теплоемкость вещества (С), [Дж/(кг∙К)] — это теплота, необходимая для повышения температуры 1кг данного вещества на 1К. Удельная теплоемкость воды равна 4184Дж/(кг К). Значение Q можно рассчитать, зная теплоемкость С: Q = m С∆Т. Молярная теплоемкость вещества (С m), [Дж/моль∙К)] — это теплота, необходимая для повышения температуры 1 моль данного вещества на 1 К. Типы состояния системы. Равновесное состояние — макроскопическое состояние, к которому приходит изолированная система в результате самопроизвольно протекающих внутри нее процессов. В этом состоянии система характеризуется постоянством ее термодинамических параметров во времени. Параметры, при которых наблюдается такое состояние, называют равновесными. Равновесное состояние — динамически сложившееся состояние, при котором происходящие внутри системы встречные процессы (испарена и конденсация, растворение и кристаллизация, прямая и обратная химическая реакции и т.д.) протекают с одинаковой скоростью, так что в целом система не изменяет своих макросвойств. Стационарное состояние также характеризуется постоянством параметров системы, однако при этом, в отличие от равновесного состояния, происходит непрерывный обмен веществом и энергией с окружающей средой. Переходное, или неравновесное, состояние — это такое состояние, при котором параметры системы изменяются во времени, стремятся достигнуть равновесных значений. Термодинамические процессы. Изменение во времени любого из параметров, характеризующего систему, называется процессом. Обратимые процессы — переход системы из одного состояния в друга и обратно осуществляется по одному и тому же пути, и после возвращения в исходное состояние в окружающей среде не остается макроскопических изменений. При протекании равновесного процесса система последовательно проходит через бесчисленное множество близких равновесных состояний. В случае осуществления необратимого процесса систему и ее окружение невозможно вернуть в исходное состояние без затраты энергии. Реальные процессы, происходящие в природе, всегда необратимы. Процессы, протекающие при постоянных температуре, давлении и объеме, называют изотермическими, изобарными (изобарическими) или изохорными (изохорическими) соответственно. Адиабатический процесс происходит без обмена теплотой между системой и окружающей средой (∆ Q = 0) Самопроизвольный процесс может происходить без затраты энергии на его протекание за счет какого-либо другого процесса или без притока энергии извне. Несамопроизвольный процесс может происходить только с затратой энергии, поступающей из окружающей среды или высвобождающейся за счет какого-либо другого процесса.
|
||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 56; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.34.182 (0.01 с.) |