
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические характеристики рабочего тела, параметры состояния в идеальных и реальных газах, молекулярно-кинетическое обоснование. Первый и второй законы термодинамики. Изменение энтропии.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Совершенный газ – упрощенная модель реального газа, с принятыми допущениями: · Полностью отсутствуют межмолекулярные силы; · Молекулы в виде материальных точек, обладающих массой; · Теплоемкость, газовая постоянная, показатель адиабаты и молярная масса неизменны и не зависят от температуры; · Агрегатное состояние неизменно при любых условиях. Газ можно рассматривать как совершенный до температуры 2500 К, при более высоких температурах начинаются процессы диссоциации, ионизации и рекомбинации. Идеальный газ – совершенный газ, лишенный свойств вязкости. Параметры состояния рабочего тела: Давление. Согласно МКТ, давление – результат ударов хаотически и непрерывно движущихся молекул о стенки сосуда. Основное уравнение кинетической теории для модели идеального газа:
При постоянной температуре давление определяется только числом молекул в единице объема, и не зависит от рода молекул. При Температура. Согласно МКТ, абсолютная термодинамическая температура – величина, пропорциональная средней кинетической энергии поступательного движения молекул газа. По уравнению Больцмана, для модели идеального газа:
Абсолютный ноль температуры – ноль по шкале Кельвина ( Плотность и удельный объем. Это количество вещества, заключенное в единице объема:
Эти три параметра состояния связаны между собой уравнением Клапейрона-Менделеева, для одного килограмма идеального газа:
Значение универсальной газовой постоянной при н.у. (101325 Па и 273,15 К) равно:
Вид термодинамического процесса определяется показателем политропы
При Теплоемкость тела – количество тепла, необходимое для нагрева единицы вещества на один градус Кельвина. Истинная теплоемкость соответствует бесконечно малому изменению температуры:
В газодинамике используют массовые теплоемкости – изобарную и изохорную:
Энтальпия – сумма потенциальной внутренней энергии
Уравнение состояния через полную энтальпию и внутреннюю энергию
Модуль упругости – количественная оценка сжимаемости газа, отношение изменения давления к вызванному им относительному изменению плотности:
Упругость газов, в зависимости от давления и вида термодинамического процесса, на 3-4 порядка меньше упругости капельных жидкостей. На малых скоростях газовых потоков их свойство сжимаемости проявляется незначительно, поэтому их рассматривают как поток капельной жидкости. Первый закон термодинамики: подводимые к газу удельное тепло трения
Второй закон термодинамики: рост количества подводимого тепла увеличивает приращение энтропии, в то время как рост температуры, при которой к системе подводится тепло, снижает приращение энтропии.
Свойства реальных рабочих тел описываются уравнением Ван-дер-Ваальса:
К увеличению давления приводит:
Также уравнение состояния может иметь вид 5. Плотность и сплошность среды, основные определения, виды жидкостей, виды течений. Понятие о полных параметрах состояния.
Плотность – один из параметров состояния рабочего тела. Обратная величина для удельного объема.
Относительная плотность – отношение плотности вещества к плотности некоторого вещества при определенных физических условиях (воды при 3,980С и 101325 Па или сухого воздуха при 200С и 101325 Па).
Плотность в точке – предел отношения
Постулат о сплошности (Даламбера-Эйлера): при изучении направленного движения жидкости и сил взаимодействия их с твердыми телами, жидкости можно рассматривать как сплошную среду, лишенную молекул и межмолекулярных пространств. Для справедливости постулата необходимо выполнение двух условий: 1) характерный размер тела должен быть много больше размера тела элементарной частицы; 2) размер элементарной частицы должен быть много больше длины свободного пробега молекул. Количественная оценка сплошности среды производится с помощью критерия Кнудсена.
В зависимости от величины · · o o o Жидкая частица – мысленно выделенная замкнутая поверхность с постоянной массой, возможностью перемещаться в пространстве, изменяя форму. Контрольный объем – мысленно выделенная замкнутая проницаемая поверхность постоянного объема и неизменной формы, масса которого изменяется в зависимости от потока жидкости, проходящего через этот объем. Состояние газа оценивается термодинамическими параметрами состояния – давлением, температурой, плотностью, которые являются статическими и воспринимаются объектом, неподвижным относительно потока. Параметры заторможенного потока – параметры при торможении потока без потерь и энергообмена с окружающей средой, когда вся кинетическая энергия потока полностью переходит в потенциальную, и параметры принимают максимальное значение.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.149 (0.012 с.) |

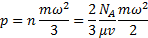
 число молекул вещества в
число молекул вещества в  ;
;  масса молекулы, кг;
масса молекулы, кг;  средняя квадратичная скорость молекул, м/с;
средняя квадратичная скорость молекул, м/с; 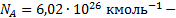 число Авогадро (число молекул в 1 кмоле);
число Авогадро (число молекул в 1 кмоле);  молярная масса вещества, кг/кмоль;
молярная масса вещества, кг/кмоль;  молярный объем вещества,
молярный объем вещества, 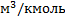 . Моль – количество вещества, в котором содержится столько молекул, сколько содержится атомов в изотопе углерода массой 0,012 кг.
. Моль – количество вещества, в котором содержится столько молекул, сколько содержится атомов в изотопе углерода массой 0,012 кг.
 свойства газа определяются только числом молекул.
свойства газа определяются только числом молекул.
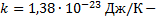 константа Больцмана.
константа Больцмана. ), при котором прекращается движение молекул.
), при котором прекращается движение молекул.

 удельная газовая постоянная, Дж/кг∙К. При умножении
удельная газовая постоянная, Дж/кг∙К. При умножении  на молярную массу, получается универсальная газовая постоянная, одинаковая для всех газов (на основании закона Авогадро о том, что при одинаковых давлении и температуре все газы имеют одинаковый молярный объем, при н.у. равный 22,4 м3/кмоль).
на молярную массу, получается универсальная газовая постоянная, одинаковая для всех газов (на основании закона Авогадро о том, что при одинаковых давлении и температуре все газы имеют одинаковый молярный объем, при н.у. равный 22,4 м3/кмоль).
 , из уравнения политропного процесса, для идеальных газов:
, из уравнения политропного процесса, для идеальных газов: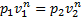

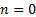 процесс будет изобарным,
процесс будет изобарным,  изотермическим,
изотермическим,  изохорным,
изохорным,  адиабатным. Чем выше показатель политропы, тем меньше сжимаемость и больше упругость газов.
адиабатным. Чем выше показатель политропы, тем меньше сжимаемость и больше упругость газов.
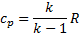

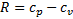

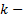 показатель адиабаты.
показатель адиабаты. и потенциальной энергии давления
и потенциальной энергии давления  для единицы вещества:
для единицы вещества:
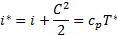
 :
:

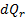 и внешнее тепло
и внешнее тепло  расходуются на изменение внутренней энергии
расходуются на изменение внутренней энергии 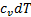 и на работу деформации
и на работу деформации  , иначе говоря, на изменение энтальпии и работу проталкивания:
, иначе говоря, на изменение энтальпии и работу проталкивания:


 . Влияние переменных уравнения на давление:
. Влияние переменных уравнения на давление: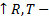 увеличение скорости хаотического движения молекул;
увеличение скорости хаотического движения молекул; увеличение концентрации молекул увеличивает межмолекулярные силы;
увеличение концентрации молекул увеличивает межмолекулярные силы; уменьшается оттягивающее действие на молекулы, приближающиеся к стенке;
уменьшается оттягивающее действие на молекулы, приближающиеся к стенке;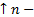 уменьшение свободного пробега молекул и увеличение количества ударов о стенку;
уменьшение свободного пробега молекул и увеличение количества ударов о стенку; , где
, где  коэффициент сжимаемости природного газа, определяется по номограммам.
коэффициент сжимаемости природного газа, определяется по номограммам.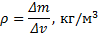

 при стягивании объема к данной внутренней точке.
при стягивании объема к данной внутренней точке.
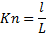
 длина свободного пробега молекул, расстояние, проходимое молекулами от одного соударения до другого, ближайшее время соударения;
длина свободного пробега молекул, расстояние, проходимое молекулами от одного соударения до другого, ближайшее время соударения;  характерный размер тела.
характерный размер тела.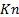 различают несколько видов течений:
различают несколько видов течений: течения сплошных сред. При обтекании твердых тел поток сплошной среды полностью останавливается на поверхности, ограничивающей эти тела (гипотеза Прандтля о прилипании). Скорость и температура среды на поверхности тела равны параметрам самого тела. Между стенкой и средой возникает переходный слой толщиной
течения сплошных сред. При обтекании твердых тел поток сплошной среды полностью останавливается на поверхности, ограничивающей эти тела (гипотеза Прандтля о прилипании). Скорость и температура среды на поверхности тела равны параметрам самого тела. Между стенкой и средой возникает переходный слой толщиной  , в котором скорость потока возрастает от нуля до скорости невозмущенного потока.
, в котором скорость потока возрастает от нуля до скорости невозмущенного потока.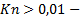 течения разряженных сред. Различают три степени разреженности:
течения разряженных сред. Различают три степени разреженности: течения со скольжением, при которых наблюдается скольжение потока относительно стенки препятствия и различие температур поверхности стенки и потока. Поток ведет себя так, как будто часть его пограничного слоя условно проникла внутрь обтекаемого тела. Для исследования применяются уравнения для сплошных сред с поправками на скачки скорости и температуры.
течения со скольжением, при которых наблюдается скольжение потока относительно стенки препятствия и различие температур поверхности стенки и потока. Поток ведет себя так, как будто часть его пограничного слоя условно проникла внутрь обтекаемого тела. Для исследования применяются уравнения для сплошных сред с поправками на скачки скорости и температуры. переходная область течения разреженных газов. Постулат о сплошности, понятие о плотности в точке, законы газовой динамики сплошной среды не применяются.
переходная область течения разреженных газов. Постулат о сплошности, понятие о плотности в точке, законы газовой динамики сплошной среды не применяются. свободномолекулярные течения. Газ состоит из отдельных молекул, не взаимодействующих между собой. Молекулы взаимодействуют с обтекаемыми телами только при соударении с ними. Расчет производится методами статической физики.
свободномолекулярные течения. Газ состоит из отдельных молекул, не взаимодействующих между собой. Молекулы взаимодействуют с обтекаемыми телами только при соударении с ними. Расчет производится методами статической физики.


