
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
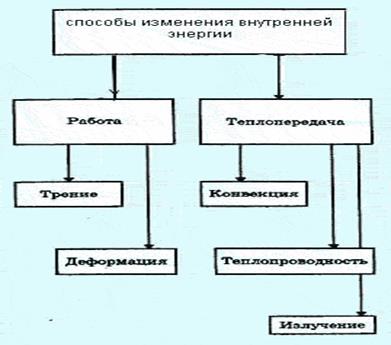
Способы изменения внутренней энергииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте Внутреннюю энергию можно изменить двумя способами.
Если работа совершается над телом, его внутренняя энергия увеличивается. Если работу совершает само тело, его внутренняя энергия уменьшается. Теплопередача — физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к более холодному, что является следствием второго закона термодинамики Всего существует три простых (элементарных) вида передачи тепла: Теплопроводность, Конвекция, Тепловое излучение Существуют также различные виды сложного переноса тепла, которые являются сочетанием элементарных видов. Основные из них: теплоотдача (конвективный теплообмен между потоками жидкости или газа и поверхностью твёрдого тела); теплопередач а (теплообмен от горячей жидкости к холодной через разделяющую их стенку); конвективно-лучистый перенос тепла (совместный перенос тепла излучением и конвекцией); термомагнитная конвекция. Количество теплоты — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин. Единица измерения: Джоуль Дж
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T:
Единица измерения теплоёмкости в системе СИ — Дж/К. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
4.11. Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабата соответственно. Изобарный процесс
Графики изопроцессов в различных системах координат Изохорный процесс — процесс изменения состояния термодинамической системы при постоянном объёме (
Линия, изображающая изохорный процесс на диаграмме, называется изохорой. Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре ( При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. Изоборический процесс описывается законом Гей-Люссака V/T=const Изоэнтропийный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии ( Работа газа Рассмотрим газ, находящийся в цилиндре с поршнем, позволяющем менять объем газа (рис 9.2). Отметим, что слово «газ» здесь совершенно условно. Это может быть жидкость, кристалл и вообще любое тело. Цилиндр контактирует с нагревателем или холодильником, который может сообщать газу тепло или отбирать его. Пусть на поршень оказывается внешнее давление, величина которого может быть любой.
Все процессы, которые будем рассматривать ниже, будут квазистатическими, т.е. медленными настолько, чтобы можно было считать, что в каждый момент газ находится в состоянии т.д.р. Если очень быстро сжать газ, то давление его у поршня окажется на какой-то момент больше, чем в стальном объеме, и тогда нельзя будет говорить о давлении газа вообще. Такой процесс не является квазистатическим. Приближенно квазистатическими являются и процессы, достаточно быстрые с технической точки зрения, например процессы, происходящих в цилиндрах двигателя автомашины во время работы мотора (оказывается, для приближенной квазистатичности требуется, чтобы скорость поршня была мала по сравнению со скоростью звука в газе). Работа над газом выполняется внешними силами при его сжатии. Работа самого газа выполняется при его расширении. Пусть газ расширяется так, что поршень на рис.9.2 поднимается на величину dx. Тогда газ выполнит работу
Эта величина называется элементарной работой газа. Работа при расширении газа от объема V1до V2 будет равна
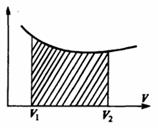
Если по одной оси отложить объем газа, по другой – его давление (плоскость P – V), то работа (9.9) будет изображаться площадью под кривой P(V) (рис.9.3). Процесс расширения от объема V1 до объема V2 может происходить различным образом: например, можно при этом изолировать газ от нагревателя или, наоборот, нагревать газ и т.д. Иначе говоря, при перемещении из точки 1 в точку 2 в газе могут происходить различные процессы, даже если зафиксировано начальное и конечное состояния. В каждом процессе работа будет иметь свое значение, так как площадь под кривой процесса будет различной (кривые I, II, и III на рис.9.3). Таким образом, выполняемая газом работа зависит от процесса, который с ним происходит. Заметим, что работа положительна, если она выполняется газом, и отрицательна, если внешние силы выполняют ее над газом.
Внутренняя энергия системы может изменяться за счет энергии, сообщаемой системе извне. Эта энергия может сообщаться системе посредством двух процессов: либо за счет работы, производимой внешними силами над системой, либо за счет передачи ей тепла. Рассмотрим газ, сжимаемый в сосуде поршнем под действием силы F (рис.). Пусть под действием этой силы поршень переместился на расстояние dh, сжав газ. Работа силы на пути dh ‑ dA = Fdh. Разделив величину силы на площадь поршня, получим давление P, а умножив на S, получим изменение объема газа dV. Таким образом, производимая над газом работа dA = PdV. (2.30)
Такую же по величине работу совершает газ при расширении, перемещая поршень. При этом dV положительно, если газ расширяется, и отрицательно при сжатии газа. Соответственно работа dA положительна или отрицательна: в первом случае система производит работу сама, во втором — внешние силы производят работу над системой. Графически процесс изменения состояния газа при его расширении или сжатии изображается на кривой P, V участком 1-2 на рис. Полная работа, совершаемая газом, при расширении от V1 до V2:
Эта работа численно равна заштрихованной площади, заключенной под кривой P (V).
Рассмотрим способы передачи телу тепла. При соприкосновении тел либо при взаимодействии тел через излучение, изменение внутренней энергии происходит за счет передачи энергии хаотически движущихся частиц одного тела частицам другого. Энергия, передаваемая от одного тела другому, представляет собой теплоту. Обозначим ее через Q. Теплота измеряется в тех же единицах, что и энергия. Связь между переданным теплом, изменением внутренней энергии системы и произведенной работой выражается уравнением dQ = dE + dA = dE + PdV. (2.32) Это уравнение представляет собой закон сохранения энергии применительно к механической и тепловой энергии макроскопических тел. Он получил название первого начала термодинамики. Важно учесть, что в выражении (2.32) работа и количество тепла не есть полные дифференциалы каких-либо величин, в то время как внутренняя энергия является таковой. Можно говорить о внутренней энергии в данном состоянии, а не о количестве тепла или работы, которыми обладает тело. Нельзя делить энергию тела на тепловую и механическую, речь идет лишь об изменении внутренней энергии тела за счет количества тепла, переданного ему или отданного им, и количества совершенной работы. Это разделение неоднозначно и зависит от начального и конечного состояний тела и от характера совершаемого процесса. Поэтому, например, в процессе перехода из состояния 1 в состояние 2 изменение внутренней энергии может быть равно нулю, а тело при этом может приобрести или потерять энергию.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1051; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.012 с.) |



 ). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
 )(
)( ). Изотермический процесс описывается законом Бойля — Мариотта:
). Изотермический процесс описывается законом Бойля — Мариотта: ). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:  где
где  — показатель адиабаты, определяемый типом газа.
— показатель адиабаты, определяемый типом газа.
 (S – площадь поршня). Получим
(S – площадь поршня). Получим


 . (2.31)
. (2.31)



