
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности кинетики реакций ХИО в гетерогенных системахСодержание книги
Поиск на нашем сайте
Рассмотренные выше уравнения для расчета скорости изотопного обмена получены без введения ограничений на агрегатное состояние реагирующих веществ и справедливы для гомогенных и гетерогенных систем с одной лишь оговоркой: скорость процесса должна определяться собственно скоростью химической реакции изотопного обмена и на нее не должны оказывать влияние диффузионные составляющие. В качестве примера такого влияния приведем часто встречающийся случай реакции ХИО между газом и жидкостью, протекающей в жидкой фазе или на границе раздела газ – жидкость. При этом скорость подвода реагента из газовой фазы определяется поверхностью раздела. При изменении интенсивности перемешивания жидкой фазы получают следующую зависимость экспериментальной константы скорости от интенсивности перемешивания (рис. 13).
Рис. 13. Зависимость k при изотопном обмене в системе газ-жидкость от интенсивности перемешивания жидкой фазы Как видно, приведенную зависимость модно разбить на три участка. На участке I значение k линейно увеличивается при увеличении интенсивности перемешивания. Эту область называют диффузионной. На участке II, который называют переходной областью, рост величины k замедляется. Наконец, на участке III значение k при увеличении N перестает изменяться. Эту область называют кинетической. В случаях, когда при проведении эксперимента есть доказательства протекания реакции в химической области, для реакций ХИО в гетерогенных системах часто вместо величины R используют удельную величину R уд.. Так, если реакция протекает на границе раздела фаз, то скорость обмена относят к единице поверхности S. Тогда уравнение, например, (9.11) записывают как а размерность R уд. становится моль/(м2.мин). При протекании реакции ХИО в жидкой фазе величину R уд. относят к единице объема жидкой фазы и ее размерность моль/л.мин. Если при этом в жидкой фазе находится катализатор, то при использовании гетерогенного катализатора с известной поверхностью величину R уд. выражают в единицах моль/(см2 поверхности катализатора.мин) или моль/(г катализатора.мин), а для гомогенного катализатора – в единицах моль/(моль катализатора-мин). При этом в записи кинетического уравнения появляются соответствующие параметры.
Заключение В заключение отметим, что изложенный в настоящем учебном пособии материал по существу является применением известных положений физической химии к специфической области разделения изотопов легких элементов, причем основное внимание уделено обратимым процессам разделения. В отличие от необратимых процессов, которые используются для разделения изотопов тяжелых элементов, в частности, урана, и для рассмотрения которых необходимо применять положения неравновесной термодинамики, для описания обратимых процессов достаточно законов химической и статистической термодинамики. Особенность реакций химического изотопного обмена заключается в том, что в них концентрации реагирующих веществ в ходе реакции не изменяются. Это дает возможность на основе обычных для химических реакций термодинамических и кинетических закономерностей получить более простые соотношения, адекватно описывающие поведение системы. Освоение изложенного выше материала является первой ступенью изучения технологии процессов разделения изотопов. Малое отличие однократных разделительных эффектов от 1 и необходимость его многократного умножения делает изотопную продукцию чрезвычайно дорогостоящей, и поэтому создание оптимальных со всех точек зрения изотопных производств невозможно без понимания особенностей изотопного равновесия и кинетики реакций изотопного обмена. Именно на этой основе в последующем студенты будут изучать принципы построения разделительных каскадов и их оптимизации.
Библиографический список 1. Даниэльс Ф., Олберти Р.. Физическая химия. – М.: Мир, 1978. – 647с. 2. Андреев Б. М., Зельвенский Я. Д., Катальников С. Г. Тяжелые изотопы водорода в ядерной технике: учеб. пособие для вузов. – М.: ИздАТ, 2000. – 344с. 3. Разделение изотопов биогенных элементов в двухфазных системах/ Б. М. Андреев и [др]. – М.: ИздАТ, 2003. – 376с. 4. Гетерогенные реакции изотопного обмена трития/ Б. М.Андреев и [др]. – М.: Изд-во УРСС, 1999. – 208с. 5. Розен А. М.. Теория разделения изотопов в колоннах – М.: Атомиздат, 1960. – 438с.
РОЗЕНКЕВИЧ Михаил Борисович
Термодинамика и кинетика
|
||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 77; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.126.51 (0.006 с.) |


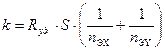 ,
,  Учебное издание
Учебное издание


