
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концентрационная зависимость коэффициента разделения
Большинство рабочих веществ, используемых для разделения изотопов водорода, содержат в своем составе более одного атома водорода (Н2, Н2О, Н2S, NH3 и т.д.). Как отмечалось выше, такие молекулы могут участвовать в реакциях ГМИО (уравнение (2.6)). Если скорость реакции ГМИО для молекул хотя бы одного из рабочих веществ в процессе ХИО велика, при изменении концентрации целевого изотопа в широких пределах будет наблюдаться непрерывная концентрационная зависимость коэффициента разделения. Рассмотрим наиболее простой случай, когда молекулы одного рабочего вещества содержат два обменивающихся атома, а другого – только один, причем тяжелый изотоп В концентрируется в веществе с двумя обменивающимися атомами: A2X + BY ↔ ABX + AY (7.1) ABX + BY ↔ B2X + AY (7.2) Примером такой химобменной системы является, например, изотопный обмен между водородом и гидридом палладия (PdH). В области малых концентраций изотопа В для реакции (7.1) можно записать следующие уравнения: - константа равновесия – - константа равновесия при бесконечно высокой температуре – - коэффициент разделения – Аналогично для области высоких концентраций изотопа В (реакция (7.2), обозначение коэффициента разделения - a ВА):
Для реакции ГМИО вещества A2X A2X + B2X ↔ 2ABX (7.3) константа равновесия равна Преобразование приведенных уравнений приводит к следующему соотношению:
Из уравнения (7.5) следует, что a BA = a AB при условии, если константа равновесия реакции ГМИО КАВХ равна
Получим уравнение, описывающее эту зависимость. В соответствии с определением коэффициента разделения: Преобразуем это уравнение так, чтобы выразить величину a через a AB:
Первый сомножитель в полученном уравнении равен К1=2 a АВ. Величину Таким образом, зная значение коэффициента разделения для области малых концентраций изотопа В и рассчитав по квадратному уравнению, аналогичному уравнению (2.11), отношение мольных концентраций изотопологов Как следует из уравнения (7.5), степень зависимости коэффициента разделения от концентрации определяется тем, насколько велико отклонение константы равновесия реакции ГМИО от равновероятностного значения. Так, например, для уже упомянутой выше химобменной системы H2 – PdH величины коэффициентов разделения в изотопной смеси протий – тритий при Т=300 К во всей области концентраций трития изменяются более чем в 1,5 раза: aНТ=2,65 и aТН=4,13. В табл. 3 приведены значения констант равновесия реакции ГМИО для ряда веществ, представляющих практический интерес. Таблица 3 Константы равновесия реакций ГМИО для ряда водородсодержащих веществ при Т=300 К
*- для реакции (4.5) **- для реакции (4.6) Из данных таблицы видно, что все экспериментальные величины констант равновесия реакций ГМИО меньше, чем константы равновесия при равновероятностном распределении изотопов. Наибольшие отклонения при этом наблюдаются для всех изотопологов водорода. Используя алгоритм приведенного выше вывода, можно получить уравнение, описывающее зависимость коэффициента разделения от концентрации целевого изотопа, для случая, когда целевой изотоп концентрируется в веществе с одним обменивающимся атомом:
AX + АBY ↔ BX + A2Y (7.8) AX + B2Y ↔ BX + AВY (7.9) В этом случае связь между коэффициентами разделения в области высокой и низкой концентрации целевого изотопа будет следующей: а концентрационная зависимость a описывается уравнением: Примером такой химобменной системы является изотопный обмен между трехфтористым метаном и водородом. Из уравнения (7.10) следует, что в этой системе коэффициент разделения должен уменьшаться при увеличении концентрации тяжелого изотопа. Действительно, при температуре 300 К в этой системе коэффициент разделения a HD =4,42, a DH =3,62. Уравнения, описывающие концентрационную зависимость коэффициента разделения при изотопном обмене веществ, содержащих по два обменивающихся атома, представлены ниже: A2X + АBY ↔ АBX + A2Y (7.12) AВX + B2Y ↔ B2X + AВY (7.13) Как видно, в расчетные уравнения входят константы равновесия реакций ГМИО для обоих обменивающихся веществ. При этом характер концентрационной зависимости коэффициента разделения определяется тем, для какого из веществ константа равновесия реакции ГМИО больше. Так, для изотопного обмена в системе вода – водород Н2О +HD ↔ HDO + H2, НDО +D2 ↔ D2O + HD, как видно из данных табл. 3, К HD < KHDO, поэтому в этой системе коэффициент разделения уменьшается при увеличении концентрации, т.е, a HD < a DH. Наоборот, при изотопном обмене воды с сероводородом Н2O +HDS ↔ HDO + H2S, НDО +D2S ↔ D2O + HDS, К HDS > KHDO, поэтому в этой системе коэффициент разделения при увеличении концентрации дейтерия несколько увеличивается. В табл. 4 приведены граничные значения коэффициентов разделения для различных химобменных систем и разных изотопных смесей. Таблица 4 Граничные значения коэффициентов разделения для различных химобменных систем. Т=300 К
Как видно из приведенных данных, наиболее резкая концентрационная зависимость наблюдается для коэффициента разделения в системе вода – водород, что обусловлено значительным отклонением константы равновесия реакции ГМИО для водорода от равновероятностного значения (табл. 3). Кроме того, как было показано выше, для первых двух систем величина коэффициента разделения уменьшается при увеличении концентрации тяжелого изотопа, а для двух последних – увеличивается.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.70.255 (0.015 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ,
, ,
, (запись a AB принята для обозначения коэффициента разделения реакции в области малых концентраций изотопа В).
(запись a AB принята для обозначения коэффициента разделения реакции в области малых концентраций изотопа В). ,
,  ,
, 
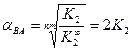 .
.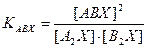 и
и  .
. или (7.4)
или (7.4)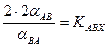 и
и  . (7.5)
. (7.5) . При отклонении KABX от равновероятностной величины должна наблюдаться концентрационная зависимость коэффициента разделения. При этом, если реакция ГМИО протекает в молекулах того вещества, в котором концентрируется тяжелый изотоп В, при увеличении его концентрации коэффициент разделения будет расти.
. При отклонении KABX от равновероятностной величины должна наблюдаться концентрационная зависимость коэффициента разделения. При этом, если реакция ГМИО протекает в молекулах того вещества, в котором концентрируется тяжелый изотоп В, при увеличении его концентрации коэффициент разделения будет расти.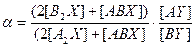 (7.6)
(7.6)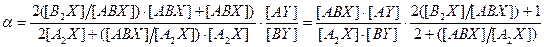 .
. с использованием константы равновесия реакции ГМИО можно выразить как
с использованием константы равновесия реакции ГМИО можно выразить как 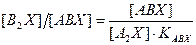 . Тогда получим окончательно:
. Тогда получим окончательно: . (7.7)
. (7.7) 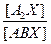 , можно определить величину коэффициента разделения при любой концентрации целевого изотопа.
, можно определить величину коэффициента разделения при любой концентрации целевого изотопа.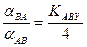 , (7.10)
, (7.10)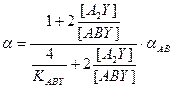 . (7.11)
. (7.11) , (7.14)
, (7.14)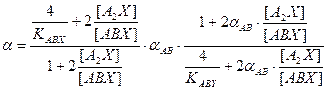 . (7.15)
. (7.15) 


