
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 2. Особенности кинетики реакций изотопного обмена
9. Кинетика реакций ХИО при значении коэффициента разделения, близком к 1 Основными особенностями реакций химического изотопного обмена, отличающими их от обычных химических реакций, является то, что реакции ХИО всегда являются обратимыми и при их протекании мольные концентрации реагирующих веществ остаются неизменными. Для реакции AX + BY ↔ BX + AY (9.1) это означает, что в любой момент времени
Единственным результатом реакции ХИО является перераспределение изотопов элемента между реагирующими веществами, т.е. изменение отношения между концентрациями AX и BX, AY и BY. За скоростью этого процесса W можно следить по изменению концентраций изотопологов каждого из реагирующих веществ во времени. После достижения системой обменивающихся веществ состояния изотопного равновесия концентрации изотопологов перестают изменяться и наблюдаемая скорость реакции равна W =0. Это, однако, не означает, что при равновесии вещества перестают обмениваться изотопами. В этом состоянии суммарная скорость R переноса атомов A и B между веществами ЭX и ЭY(Э – элемент, состоящий из изотопов А и В) остается такой же, как и в начальный момент времени, однако скорости их переноса из вещества ЭX в ЭY и наоборот равны между собой. Следовательно, в любой момент времени наблюдаемая скорость реакции изотопного обмена по отношению к скорости обмена элемента между веществами составляет только долю, пропорциональную степени отклонения распределения концентрации изотопов А и В в веществах от равновесного. Качественная картина для иллюстрации вышесказанного представлена на рис. 11.
Рис. 11. Изменение наблюдаемой скорости изотопного обмена во времени при a ® 1 Еще одна особенность реакций изотопного обмена легких элементов заключается в том, чтов фиксированных условиях кинетика изотопного обмена для всех элементов, кроме водорода, подчиняется единому экспоненциальному уравнению, которое содержит только одну константу – скорость суммарного обмена R. Это, однако, не относится к случаям усложненного изотопного обмена, например, к процессам, когда скорость обмена лимитируется диффузионным подводом молекул изотопологов реагирующих веществ к поверхности контакта фаз, или в которых принимают участие вещества, содержащие изотопы элемента в неэквивалентных положениях. Например, в системе моноэтаноламин (NH2-CH2-CH2-OH) – вода скорость изотопного обмена водорода в группах NH2-, OH- и радикале различна.
В соответствии с законом действующих масс скорость реакции между двумя веществами определяется следующим уравнением:
где Реакции изотопного обмена в общем случае протекают в несколько промежуточных стадий, и общую скорость реакции определяет самая медленная из них. Формально записанная реакция (9.1) является бимолекулярной (p и q =1), хотя на самом деле ее порядок по каждому из реагирующих веществ может быть и другим, в том числе и дробным. При этом порядок по каждому из реагирующих веществ определяют экспериментально, исследуя зависимость величины R от концентрации каждого из реагирующих веществ. Тем не менее, при фиксированной концентрации реагирующих веществ и отсутствии диффузионных составляющих или усложненного изотопного обмена кинетическое уравнение, описывающее изменение изотопных концентраций в реагирующих веществах, остается экспоненциальным. Получим это уравнение для реакции (9.1). Наблюдаемая скорость реакции при любой концентрации изотопов может быть записана с помощью следующего уравнения:
где При достижении равновесия x ¥ = y ¥ (a ≈1!) и Из уравнения материального баланса:
получим Подставив уравнение (9.6) в уравнение (9.4), получим: Уравнение (9.7) можно интегрировать:
После интегрирования получим: или
В уравнении (9.10) величина F называется степенью обмена, Из полученных уравнений видно, что размерность величины k – обратное время (с-1, мин-1, ч-1), а значение скорости R имеет размерность моль/с, моль/мин и т.д. При этом абсолютная величина k зависит от условий проведения эксперимента, конкретнее – от используемых количеств обменивающихся веществ. Если участвующие в реакции ХИО вещества имеют n и m эквивалентных атомов обменивающихся изотопов, то уравнение (9.9) должно быть записано в следующем виде:
а уравнение (9.11)
Для полуколичественной характеристики скорости изотопного обмена часто используется величина времени полуобмена t 1/2 – время, за которое в системе достигается значение степени обмена F = 0,5: Как и всякая константа скорости химической реакции, наблюдаемая константа скорости реакции ХИО зависит от температуры. В соответствии с уравнением Аррениуса:
В этом уравнении величина R – универсальная газовая постоянная.
|
||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.252.201 (0.006 с.) |
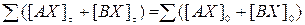 и
и . (9.2)
. (9.2)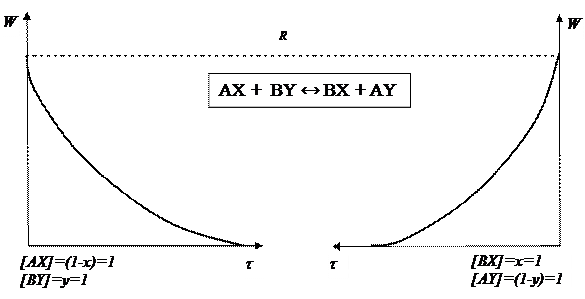

 , (9.3)
, (9.3)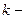 константа скорости реакции,
константа скорости реакции,  ,
, 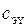 – концентрации веществ, p, q – порядок реакции по соответствующим веществам.
– концентрации веществ, p, q – порядок реакции по соответствующим веществам.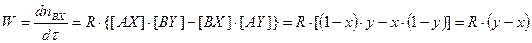 , (9.4)
, (9.4)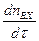 – изменение количества молей изотополога BX в единицу времени.
– изменение количества молей изотополога BX в единицу времени.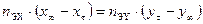 , (9.5)
, (9.5)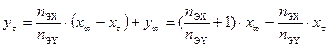 . (9.6)
. (9.6)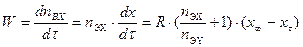 . (9.7)
. (9.7)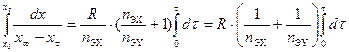 . (9.8)
. (9.8)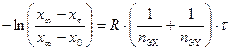 (9.9)
(9.9) . (9.10)
. (9.10) , а значение k – экспериментально наблюдаемой константой скорости реакции изотопного обмена:
, а значение k – экспериментально наблюдаемой константой скорости реакции изотопного обмена: (9.11)
(9.11)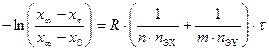 (9.12),
(9.12),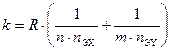 . (9.13)
. (9.13)  . (9.14)
. (9.14)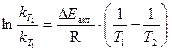 . (9.15)
. (9.15) 


