
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика реакций ХИО при значении коэффициента разделения, значительно отличающемся от 1Содержание книги
Поиск на нашем сайте
При выводе уравнения (9.8) было сделано допущение о том, что значения равновесных концентраций в обменивающихся веществах равны. Это допущение справедливо только в случаях, когда коэффициент разделения в реакции близок к 1. Для реакций с участием изотопов водорода такое допущение не может быть использовано, так как в этих реакциях коэффициент разделения значительно больше 1. Это означает, что в реакции (9.1), для которой коэффициент разделения совпадает со значением константы равновесия, скорость реакции в прямом направлении при граничных условиях х ®0, y ®1 больше скорости в обратном направлении при х ®1, y ®0 (см. рис. 12): K 3.1.1 = a =
Рис. 12. Изменение наблюдаемой скорости изотопного обмена во времени при a > 1 С учетом этого уравнение (9.4) должно быть записано в следующем виде:
В общем случае привести это уравнение к виду, удобному для интегрирования, не удастся, так как для рассматриваемого случая значения x ¥ и y ¥ не равны между собой, а величина R зависит от области концентрации целевого изотопа. Значения Тем не менее, в частных случаях кинетическую зависимость можно свести к экспоненциальной. Один из таких случаев является измерение скорости реакции при условии малой концентрации обменивающихся изотопов. При x, y << 1 уравнение (10.2) можно записать в следующем виде: Из уравнения материального баланса следует, что
Подставляя уравнение (10.4) в (10.3) и учитывая, что Алгебраические преобразования последнего уравнения приводят к выражению:
после интегрирования которого получим:
Из этого уравнения следует, что экспериментально наблюдаемая константа скорости реакции ХИО зависит также и от величины a.
Другой частный случай, когда кинетика реакции подчиняется экспоненциальному уравнению, заключается в проведении эксперимента в условиях большого избытка одного их обменивающихся веществ. Допустим, что n Э Y >> n Э X. Тогда изотопные концентрации в этом веществе в ходе эксперимента практически не изменяются и, следовательно, y 0 = y t = y ¥. Уравнение (10.2) в этом случае записывается следующим образом:
Преобразуем выражение в квадратных скобках этого уравнения: Из уравнения (1.3) следует, что
После разделения переменных и интегрирования получим: Таким образом, в рассматриваемых случаях значения экспериментально наблюдаемых констант скоростей реакции изотопного обмена связаны со значениями скоростей реакции в граничных условиях следующим образом:
а отношение их величин равно a.
|
|||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.14.131 (0.009 с.) |

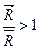 . (10.1)
. (10.1) 
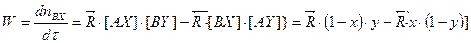 . (10.2)
. (10.2) 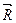 и
и 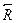 равны между собой только при установлении равновесия в системе. Таким образом, в общем случае при исследовании кинетики обмена между реагирующими веществами будет наблюдаться отклонение от экспоненциальной зависимости.
равны между собой только при установлении равновесия в системе. Таким образом, в общем случае при исследовании кинетики обмена между реагирующими веществами будет наблюдаться отклонение от экспоненциальной зависимости. 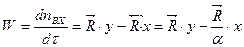 . (10.3)
. (10.3)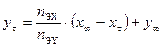 . (10.4)
. (10.4) , получим:
, получим: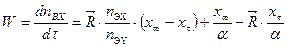 . (10.5)
. (10.5) , (10.6)
, (10.6) . (10.7)
. (10.7) . (10.8)
. (10.8)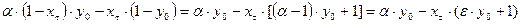 .
.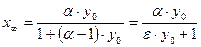 , откуда
, откуда  . Учитывая эти преобразования, уравнение (10.8) можно записать следующим образом:
. Учитывая эти преобразования, уравнение (10.8) можно записать следующим образом: . (10.9)
. (10.9)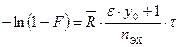 или
или 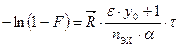 . (10.10)
. (10.10)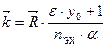 и
и 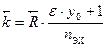 , (10.11)
, (10.11)


