
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Измерение однократного эффекта разделения
Для определения коэффициентов разделения в процессах ХИО и ФИО широко используется метод однократного уравновешивания. Он заключается в установлении равновесия между контактирующими веществами или разными фазами одного и того же вещества в каком-либо термостатируемом при определенной температуре сосуде (рис. 7), определении равновесных концентраций x и y в контактирующих веществах или фазах и расчете коэффициента разделения по уравнению (1.1).
Рис. 7. Принципиальная схема прибора для определения коэффициента разделения методом однократного уравновешивания
При всей простоте этого метода его практическое использование требует учета многих факторов. Во-первых, истинное равновесие в любой системе может быть достигнуто только через бесконечно большое время. Это означает, что в эксперименте необходимо достигнуть такой степени приближения к равновесию, при которой отклонение концентраций x и y от равновесных меньше погрешности эксперимента. Для ускорения достижения нужного приближения к равновесию обе фазы необходимо перемешивать. Для систем газ – жидкость (твердое тело) с этой целью часто используют циркуляционную схему, в которой газ принудительно циркулирует в замкнутом контуре. О достижении равновесия судят по прекращению изменения изотопных концентраций в пробах, отбираемых из обменивающихся фаз. Кроме того, для систем газ – жидкость рекомендуется использовать методику приближения к равновесию с двух сторон, когда в одном эксперименте исходные изотопные концентрации в контактирующих веществах выбираются такими, чтобы целевой изотоп переходил из жидкости (твердого тела) в газ, а в другом такими, чтобы этот изотоп переходил из газа в жидкость (твердое тело). Во-вторых, особое внимание должно быть уделено методике отбора проб. При этом следует учитывать следующие обстоятельства. При отборе промежуточных проб в течение времени достижения равновесия необходимо быть уверенным в том, что при их отборе не изменяются условия достижения равновесия. При этом объем аналитической работы можно сократить вдвое, если условия эксперимента выбрать такими, чтобы количество вещества, например, в жидкой фазе было значительно больше, чем в газовой. В этом случае при установлении в системе равновесия концентрация изотопа в жидкой фазе изменится меньше, чем погрешность анализа и ее можно считать постоянной. Кроме того, при изотопном анализе проб, особенно, отобранных при достижении равновесия, с использованием ряда методов необходимо предпринимать действия, направленные на очистку пробы соответствующей фазы от примеси другой (например, удалять пары жидкости из пробы газа). В противном случае в ходе изотопного анализа может быть получен результат, характеризующий эффективную концентрацию в соответствующей фазе.
При расчете коэффициента разделения целесообразно использовать уравнение материального баланса, приведенного ниже для варианта переноса целевого изотопа из конденсированной фазы в газовую (паровую):
где M и N – количество молей вещества в конденсированной и газовой (паровой) фазах, x 0, x ¥, y 0, y ¥ – начальные и равновесные изотопные концентрации соответственно. Из этого уравнения следует следующее выражение для коэффициента разделения (для области малых концентраций целевого изотопа):
в котором l = N / M –мольное отношение количества фаз. В ряде случаев в уравнении материального баланса необходимо учитывать количество паров жидкости m, содержащееся в условиях равновесия в газовой фазе, а иногда и количество газа, растворенного в жидкости n, так как эти процессы сопровождаются своими изотопными эффектами. В этом случае уравнение материального баланса будет следующим:
Наконец, для точности определения коэффициента разделения имеет значение правильный выбор концентрации изотопа в контактирующих фазах. Из уравнения (1.2) следует, что максимальная разность концентраций в контактирующих фазах
при малых a достигается при x ¥ =0,5. Поэтому, для повышения точности определения в эксперименте часто используют не вещества с природным изотопным составом, а обогащенные целевым изотопом. При этом, однако, следует иметь в виду, что уравнение (8.2) для расчета коэффициента разделения непригодно, так как получено для области малых концентраций, и его необходимо модифицировать с использованием полного выражения для коэффициента разделения.
Следующий метод используется для определения коэффициента разделения в процессе ФИО веществ. Он основан на измерении разности давлений насыщенных паров изотопологов вещества и называется дифференциальным методом определения a в процессе ФИО. Схема прибора для использования этого метода приведена на рис. 8. Основа прибора – U-образный манометр, заполненный какой-либо жидкостью, не смешивающейся и не взаимодействующей с веществами, для которых измеряется разность давления насыщенных паров. Чистые изотопологи вещества помещаются в специальные сосуды вверху манометра. Весь прибор термостатируется с высокой точностью поддержания температуры (при измерении значений коэффициентов разделения, близких к 1, точность поддержания температуры должна достигать ±0,02 град.).
Недостаток этого метода очевиден: для определения коэффициента разделения необходимо использовать моноизотопные вещества. Кроме того, для точности определения a Ф важна не только точность поддержания температуры в термостате, но равномерность распределения температуры по его объему, что обуславливается требованиями к минимизации разности температур между сосудами с изотопологами, которые еще более жесткие, чем к температуре в самом термостате (±0,001 – 0,002 град.).
8.2. Методы определения коэффициента разделения, основанные на умножении однократного изотопного эффекта При определении значений a Ф для большинства изотопов, кроме водорода, абсолютная величина a Ф мало отличается от 1 и, следовательно, разность изотопных концентраций между равновесными фазами при однократном их уравновешивании очень мала. В этих случаях аналитические методики не позволяют определить эти концентрации с погрешностью, обеспечивающей необходимую точность определения a Ф. Так, например, при определении a Ф в системе Н2О – HDO(a Ф =1.026, Т=373 К) Одним из наиболее распространенных методов определения a в процессе ФИО является метод равновесной перегонки (метод сокращения остатка, метод Релея). Суть этого метода заключается в медленном упаривании вещества с отводом образующегося пара (рис. 9).
Рис. 9. К выводу уравнения Релея В начальном состояние в емкости находится G 0 молей вещества с концентрацией тяжелого изотопа x 0 . При подводе количества тепла Q небольшое количество вещества dG в единицу времени испаряется и отводится из емкости. Процесс испарения ведется в равновесных условиях, поэтому концентрация тяжелого изотопа в паре y ¥ равновесна составу жидкости в емкости в каждый момент времени. Поскольку величина y ¥ меньше x, концентрация изотопа в жидкости непрерывно увеличивается. Процесс заканчивается, когда количество жидкости в емкости будет равно G к, при этом концентрация изотопа в ней составит x к.
Для каждого момента времени справедливо следующее дифференциальное уравнение:
После разделения переменных получим: Полученное уравнение называется дифференциальным уравнением Релея. Если учесть, что После интегрирования получим:
Для области малых концентраций изотопа уравнение (8.9) упрощается: Уравнения (8.9, 8.10) называются интегральными уравнениями Релея. Из них следует, что, чем больше отношение G 0 / G к, тем больше разница между концентрациями x к и x 0 и тем точнее может быть определена величина a:
Для получения достоверных результатов измерения коэффициента разделения методом сокращения остатка необходимо соблюдать ряд условий. 1. Испарение жидкости нужно вести медленно для того, чтобы пар находился в состоянии равновесия с жидкостью. При этом паровую и жидкую фазы необходимо перемешивать, чтобы избежать градиента концентрации, причем делать это так, чтобы не происходило образования брызг. 2. В ходе испарения необходимо избегать промежуточной конденсации пара, для чего весь испарительный куб помещается в воздушный термостат, температура в котором несколько превышает температуру кипения жидкости. 3. Не рекомендуется уменьшать количество жидкости в кубе больше чем в 100 раз. Эта рекомендация основана на том, что при фиксированном объеме куба в ходе испарения жидкости непрерывно изменяется соотношение между объемами жидкости и пара, причем в сторону уменьшения, и к концу перегонки количество пара в кубе может сравняться с количеством жидкости. При этом не будут выполняться условия, при которых справедливы уравнения (8.9, 8.10), так как. при их выводе объемом паровой фазы пренебрегают.
Метод Релея может быть использован и в дифференциальной форме. Их уравнения (8.7) следует, что
Если обозначить Если теперь построить график зависимости в координатах Последний метод, который рассматривается в настоящем пособии, предусматривает использование для определения a разделительной колонны. Это метод может быть применен для определения коэффициентов разделения для процессов и ФИО и ХИО. Учитывая, что теория разделительных колонн подробно будет изучаться в последующих курсах процессов и аппаратов и специальных курсах, в настоящем пособии этот метод рассматривается только на уровне принципа использования. На рис. 10 приведена принципиальная схема разделительной колонны. Ее основными элементами является собственно колонна 1, верхний (2) и нижний (3) узлы обращения потоков (ВУОП и НУОП соответственно).

Сверху в колонну поступает поток жидкости L, снизу – поток газа или пара G. Для увеличения поверхности контакта между движущимися противотоком потоками жидкости и газа (пара) колонна заполнена контактными устройствами какого-либо типа. При контакте потоков на определенном участке высоты колонны (высота, эквивалентная теоретической ступени разделения, ВЭТС или h э) изотопные концентрации в покидающих этот участок потоках соответствуют равновесным. Чем выше колонна, тем большее количество раз устанавливается такое равновесие. При этом концентрация тяжелого изотопа в потоке газа (пара) уменьшается в направлении снизу вверх, а концентрация в жидкости в направлении сверху вниз увеличивается. В ВУОП весь поток газа (пара) превращается в жидкость, которая поступает в колонну. В НУОП, наоборот, весь поток жидкости превращается в поток газа (пара), который также возвращается в колонну. Для обращения потоков используются разнообразные методы: химические, электрохимические, термические. Методика определения коэффициента разделения в колонне заключается в следующем. В НУОП колонны загружают определенное количество рабочего вещества (например, воды) и приводят его в рабочее состояние (например, начинают ее электролиз). Образующийся газовый (в рассматриваемом примере – водород) поток поступает в колонну и после нее – в ВУОП. В этом узле поток газа превращается в жидкость (водород в токе кислорода окисляется до воды), которая также возвращается в колонну. Колонна при этом термостатируется. При контакте между жидкостью и газом по высоте колонны начинает устанавливаться профиль изотопных концентраций и через определенный промежуток времени, называемый временем установления стационарного состояния, концентрации в жидкости и газе на концах колонны в пределах погрешности изотопного анализа перестают изменяться (концентрации x в, x н, y в, y н). Для области малых концентраций значение коэффициента разделения определяется по уравнению Фенске:
где n – число теоретических ступеней разделения (ЧТСР), Основная проблема этого метода измерения a заключается в определении величины h э. Ее значение является функцией большого количества переменных: физико-химических свойств веществ, температуры, типа контактных устройств и т.д. Одним из рекомендуемых приемов решения этой проблемы является введение в разделяемую смесь в небольшой концентрации третьего компонента с известным коэффициентом разделения a 13. При этом физико-химические свойства этого компонента должны быть близки к свойствам основных рабочих веществ. Тогда, определив концентрации третьего компонента на концах колонны, значение коэффициента разделения для исследуемой системы a 12 можно найти по следующему уравнению (область малых концентраций):
|
|||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 93; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.80.45 (0.032 с.) |

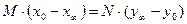 , (8.1)
, (8.1)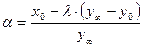 , (8.2)
, (8.2) . (8.3)
. (8.3)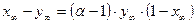 (8.4)
(8.4) Коэффициент разделения рассчитывается по уравнению
Коэффициент разделения рассчитывается по уравнению . (8.5)
. (8.5) в случае, если эксперимент проводится при концентрации дейтерия 1 ат.%, достижение погрешности в величине a Ф, равной ±0,005 (Δ a / a = 0,5 %), возможно при погрешности определения равновесных концентраций в фазах ≈0,003 ат.%. В случае воды такая точность изотопного анализа достижима. Однако если значения коэффициентов разделения будут еще меньше (например, значение a Ф в системе Н2168О – H2188O при той же температуре равно 1,004), аналитические методики не позволят измерять их с необходимой погрешностью. Поэтому определение коэффициента разделения с заданной точностью становится возможным только при условии умножения однократного изотопного эффекта.
в случае, если эксперимент проводится при концентрации дейтерия 1 ат.%, достижение погрешности в величине a Ф, равной ±0,005 (Δ a / a = 0,5 %), возможно при погрешности определения равновесных концентраций в фазах ≈0,003 ат.%. В случае воды такая точность изотопного анализа достижима. Однако если значения коэффициентов разделения будут еще меньше (например, значение a Ф в системе Н2168О – H2188O при той же температуре равно 1,004), аналитические методики не позволят измерять их с необходимой погрешностью. Поэтому определение коэффициента разделения с заданной точностью становится возможным только при условии умножения однократного изотопного эффекта.
 .
.  . (8.7)
. (8.7) , это уравнение можно интегрировать:
, это уравнение можно интегрировать: . (8.8)
. (8.8)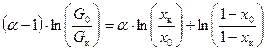 . (8.9)
. (8.9) . (8.10)
. (8.10)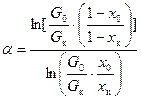 – для широкой области концентраций, (8.11)
– для широкой области концентраций, (8.11) – для области начальных концентраций. (8.12)
– для области начальных концентраций. (8.12) . (8.13)
. (8.13)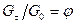 и
и 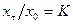 и принять во внимание, что
и принять во внимание, что  и
и  , то уравнение (8.13) можно записать следующим образом:
, то уравнение (8.13) можно записать следующим образом: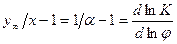 . (8.14)
. (8.14) , то, при условии, что a =const, должна быть получена прямая линия с углом наклона, равным
, то, при условии, что a =const, должна быть получена прямая линия с углом наклона, равным  , и отрезком, отсекаемым на оси ординат, равным
, и отрезком, отсекаемым на оси ординат, равным 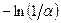 . Следовательно, в дифференциальном методе необходимо проводить последовательный отбор и изотопный анализ проб, а также определять количество жидкости в кубе при каждом отборе пробы.
. Следовательно, в дифференциальном методе необходимо проводить последовательный отбор и изотопный анализ проб, а также определять количество жидкости в кубе при каждом отборе пробы. , (8.15)
, (8.15)  , H – высота разделительной части колонны.
, H – высота разделительной части колонны. . (8.16)
. (8.16)


