
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Процессов разделения изотоповСодержание книги
Поиск на нашем сайте Российской Федерации Российский химико-технологический университет Имени Д.И. Менделеева М. Б. Розенкевич ТЕРМОДИНАМИКА И КИНЕТИКА ПРОЦЕССОВ РАЗДЕЛЕНИЯ ИЗОТОПОВ
Допущено Учебно-методическим объединением по образованию в области химической технологии и биотехнологии в качестве учебного пособия для студентов высших учебных заведений, обучающихся по специальности «Химическая технология материалов современной энергетики»
Москва 2011
ББК 24.238:24.53:24.54 Р64 Рецензенты: Доктор химических наук, профессор Московской сельскохозяйственной академии им. К. А. Тимирязева Д. А. Князев Доктор химических наук, профессор Российского химико-технологического университета им. Д.И. Менделеева В. Ю. Конюхов
Розенкевич М. Б. Р64 Термодинамика и кинетика процессов разделения изотопов: учеб. пособие/М. Б. Розенкевич. – М.: РХТУ им. Д. И. Менделеева, 2011. – 80 с. ISBN 978-5-7237-0903-4
Рассмотрены основные особенности термодинамики и кинетики обратимых процессов изотопного обмена. Введены понятия коэффициентов разделения и обогащения как основных количественных характеристик однократного разделительного эффекта. Дана классификация разделительных процессов и рассмотрена природа возникновения разделительного эффекта в них. Представлены методы расчета коэффициента разделения в обратимых процессах разделения при фазовом равновесии вещества, а также связь коэффициента разделения с константой равновесия реакции в реакциях химического изотопного обмена. Изложен квантово-статистический метод расчета констант равновесия реакций химического изотопного обмена. Даны методы определения коэффициента разделения в гетерогенных системах. Уделено внимание концентрационной зависимости коэффициента разделения в реакциях химического изотопного обмена с участием изотопов водорода. Дан обзор экспериментальных методов определения коэффициента разделения. Заключительная часть пособия посвящена рассмотрению особенностей кинетики реакций изотопного обмена при значениях коэффициента разделения, близких к 1, и значительно больших 1. Пособие предназначено для студентов, обучающихся по специальности 240601 «Химическая технология материалов современной энергетики» по специализации «Химическая технология процессов тонкого разделения».
УДК 621.039.33:544.341-42 БКК 24.238:24.53:24.54 ISBN 978-5-7237-0903-4 ÓРоссийский химико-технологический университет им. Д. И. Менделеева, 2011 ОГЛАВЛЕНИЕ
Введение ………………………………………………………………………5
Глава 1. Термодинамика процессов изотопного обмена …………………..9 1. Коэффициенты разделения a и обогащения e как основные характеристики процесса разделения ………………..9 2. Классификация разделительных процессов ……………………..12 3. Коэффициент разделения при фазовом равновесии……………..18 3.1. Коэффициент разделения в системе жидкость – пар………18 3.2. Коэффициент разделения при адсорбционном равновесии………………………………………………………….21 4. Связь коэффициента разделения реакции ХИО с константой равновесия реакции …………………………………...23 5. Квантово-статистический метод расчета коэффициента разделения реакции ХИО……………………………………………..28 5.1. Понятие суммы по состояниям………………………………28 5.2. Связь суммы по состояниям с термодинамическими функциями ……………………………….30 5.3. Константа равновесия реакции ХИО ……………………….32 5.4. Определение коэффициента разделения реакции ХИО с использованием β - факторов …………………...39 5.5. Метод Бигеляйзена – Майер для расчета коэффициента разделения реакции ХИО……….………………..41 6. Коэффициент разделения реакции ХИО в гетерогенных системах …………………………………………….44 7. Особенности термодинамики реакций изотопного обмена с участием водорода …………………………………………47 7.1. Концентрационная зависимость коэффициента разделения …………………………………………………………47 7.2. Связь между коэффициентами разделения для бинарных изотопных смесей ………………………………...53 7.3. Распределения трития между равновесными фазами в трехизотопных смесях протий – дейтерий – тритий ………….55 8. Экспериментальные методы определения коэффициента разделения …………………………………………...57 8.1. Измерение однократного эффекта разделения……………...58 8.2. Методы определения коэффициента разделения, основанные на умножении однократного изотопного эффекта..62 Глава 2. Особенности кинетики реакций изотопного обмена 9. Кинетика реакций ХИО при значении коэффициента разделения, близком к 1 ……………………………………………..69 10. Кинетика реакций ХИО при значении коэффициента разделения, значительно отличающемся от 1………………………73 11. Особенности кинетики реакций ХИО в гетерогенных системах……………………………………………..76 Заключение ………………………………………………………………….78 Библиографические ссылки………………………………………………...79
Введение Стабильные изотопы различных элементов в настоящее время находят все более широкое применение в самых разнообразных областях науки и техники – от биологии и медицины до крупномасштабной ядерной и термоядерной энергетики. Наиболее масштабное применение среди этих изотопов нашли изотопы легких элементов – водорода, лития, бора, углерода, азота, кислорода. Годовой масштаб производства, например, тяжелой воды (21Н2168О) достигал 5000 т, потребности в других изотопах составляют десятки и сотни килограммов в год. Представляется целесообразным привести некоторые сведения из истории открытия изотопов. Термин «изотоп» (от греческого isos – одинаковый и topos – место) был введен в 1910 году английским физиком Фредериком Содди. Это термин появился в научной литературе раньше экспериментального открытия явления изотопии. Первым элементом, для которого экспериментально были обнаружены изотопы, был инертный газ неон. В 1913 году английский физик Джозеф Джон Томсон, проводя эксперименты по исследованию так называемых «каналовых лучей» с использованием созданного им прототипа современных аналитических приборов – масс-спектрометров, экспериментально обнаружил изотопы неона – 2010Ne и 2210Ne. В период с 1913 по 1935 год, в основном, благодаря созданному Френсисом Астоном более совершенному масс-спектральному прибору, состоялось открытие всех основных стабильных изотопов элементов и определение их относительной распространенности в природе. В табл. 1 приведены даты открытия изотопов некоторых легких элементов, имеющих в настоящее время практическое применение. Указанные в таблице величины концентраций изотопов в природной смеси относятся ко времени их открытия и, для ряда изотопов, несколько отличаются от уточненных в более поздний период. Таблица 1 Понятие суммы по состояниям Константа равновесия реакции ХИО может быть рассчитана с использованием метода статистической термодинамики. В рамках этого метода предполагается, что каждая отдельная молекула может находиться в любом из большого количества состояний, каждое из которых определяется набором квантовых чисел. Полная энергия молекулы e, не принимая во внимание внутриядерную энергию, складывается из следующих составляющих:
т.е. поступательной, вращательной, колебательной и электронной энергии. Для системы, состоящей из большого количества молекул, находящихся в равновесии, число молекул, обладающих энергией e i, пропорционально фактору Больцмана – e - e i / kT, где k – постоянная Больцмана, k = R / N А =1,38.10-23 Дж.К-1(R – универсальная газовая постоянная, 8,314Дж.моль-1.К-1, NA – постоянная Авогадро). Полная энергия одного моль газа равна:
где Для идеального газа, когда можно пренебречь межмолекулярным взаимодействием, полная энергия одного моль может быть записана с использованием суммы по состояниям Z: где gi – статистический вес состояния с энергией e i. Статистический вес – это число микросостояний, которыми может быть реализовано данное энергетическое состояние. Одно и то же значение e i молекулы при тепловом равновесии может распределяться по разным формам движения. Так, например, e пост . может быть разложено по трем координатам (x, y, z), и, следовательно, молекула имеет три поступательные степени свободы. Часть энергии молекулы заключена в ее колебаниях, другая часть – во вращении. В приближении Борна – Оппенгеймера все внутримолекулярные виды энергии независимы друг от друга. Тогда для данной молекулы можно записать ее энергию Q (сумма по состояниям молекулы) как или Для одного моля вещества, с учетом уравнения (5.4), можно записать:
При расчете составляющих суммы по состояниям часто за точку отсчета принимают энергию молекул на низшем энергетическом уровне. Так, например, для колебательной составляющей за точку отсчета можно принять энергию молекул на нулевом колебательном уровне. Тогда:
Заключение В заключение отметим, что изложенный в настоящем учебном пособии материал по существу является применением известных положений физической химии к специфической области разделения изотопов легких элементов, причем основное внимание уделено обратимым процессам разделения. В отличие от необратимых процессов, которые используются для разделения изотопов тяжелых элементов, в частности, урана, и для рассмотрения которых необходимо применять положения неравновесной термодинамики, для описания обратимых процессов достаточно законов химической и статистической термодинамики. Особенность реакций химического изотопного обмена заключается в том, что в них концентрации реагирующих веществ в ходе реакции не изменяются. Это дает возможность на основе обычных для химических реакций термодинамических и кинетических закономерностей получить более простые соотношения, адекватно описывающие поведение системы. Освоение изложенного выше материала является первой ступенью изучения технологии процессов разделения изотопов. Малое отличие однократных разделительных эффектов от 1 и необходимость его многократного умножения делает изотопную продукцию чрезвычайно дорогостоящей, и поэтому создание оптимальных со всех точек зрения изотопных производств невозможно без понимания особенностей изотопного равновесия и кинетики реакций изотопного обмена. Именно на этой основе в последующем студенты будут изучать принципы построения разделительных каскадов и их оптимизации.
Библиографический список 1. Даниэльс Ф., Олберти Р.. Физическая химия. – М.: Мир, 1978. – 647с. 2. Андреев Б. М., Зельвенский Я. Д., Катальников С. Г. Тяжелые изотопы водорода в ядерной технике: учеб. пособие для вузов. – М.: ИздАТ, 2000. – 344с. 3. Разделение изотопов биогенных элементов в двухфазных системах/ Б. М. Андреев и [др]. – М.: ИздАТ, 2003. – 376с. 4. Гетерогенные реакции изотопного обмена трития/ Б. М.Андреев и [др]. – М.: Изд-во УРСС, 1999. – 208с. 5. Розен А. М.. Теория разделения изотопов в колоннах – М.: Атомиздат, 1960. – 438с.
РОЗЕНКЕВИЧ Михаил Борисович
Термодинамика и кинетика Российской Федерации Российский химико-технологический университет Имени Д.И. Менделеева М. Б. Розенкевич ТЕРМОДИНАМИКА И КИНЕТИКА ПРОЦЕССОВ РАЗДЕЛЕНИЯ ИЗОТОПОВ
Допущено Учебно-методическим объединением по образованию в области химической технологии и биотехнологии в качестве учебного пособия для студентов высших учебных заведений, обучающихся по специальности «Химическая технология материалов современной энергетики»
Москва 2011
ББК 24.238:24.53:24.54 Р64 Рецензенты: Доктор химических наук, профессор Московской сельскохозяйственной академии им. К. А. Тимирязева Д. А. Князев Доктор химических наук, профессор Российского химико-технологического университета им. Д.И. Менделеева В. Ю. Конюхов
Розенкевич М. Б. Р64 Термодинамика и кинетика процессов разделения изотопов: учеб. пособие/М. Б. Розенкевич. – М.: РХТУ им. Д. И. Менделеева, 2011. – 80 с. ISBN 978-5-7237-0903-4
Рассмотрены основные особенности термодинамики и кинетики обратимых процессов изотопного обмена. Введены понятия коэффициентов разделения и обогащения как основных количественных характеристик однократного разделительного эффекта. Дана классификация разделительных процессов и рассмотрена природа возникновения разделительного эффекта в них. Представлены методы расчета коэффициента разделения в обратимых процессах разделения при фазовом равновесии вещества, а также связь коэффициента разделения с константой равновесия реакции в реакциях химического изотопного обмена. Изложен квантово-статистический метод расчета констант равновесия реакций химического изотопного обмена. Даны методы определения коэффициента разделения в гетерогенных системах. Уделено внимание концентрационной зависимости коэффициента разделения в реакциях химического изотопного обмена с участием изотопов водорода. Дан обзор экспериментальных методов определения коэффициента разделения. Заключительная часть пособия посвящена рассмотрению особенностей кинетики реакций изотопного обмена при значениях коэффициента разделения, близких к 1, и значительно больших 1. Пособие предназначено для студентов, обучающихся по специальности 240601 «Химическая технология материалов современной энергетики» по специализации «Химическая технология процессов тонкого разделения».
УДК 621.039.33:544.341-42 БКК 24.238:24.53:24.54 ISBN 978-5-7237-0903-4 ÓРоссийский химико-технологический университет им. Д. И. Менделеева, 2011 ОГЛАВЛЕНИЕ
Введение ………………………………………………………………………5
Глава 1. Термодинамика процессов изотопного обмена …………………..9 1. Коэффициенты разделения a и обогащения e как основные характеристики процесса разделения ………………..9 2. Классификация разделительных процессов ……………………..12 3. Коэффициент разделения при фазовом равновесии……………..18 3.1. Коэффициент разделения в системе жидкость – пар………18 3.2. Коэффициент разделения при адсорбционном равновесии………………………………………………………….21 4. Связь коэффициента разделения реакции ХИО с константой равновесия реакции …………………………………...23 5. Квантово-статистический метод расчета коэффициента разделения реакции ХИО……………………………………………..28 5.1. Понятие суммы по состояниям………………………………28 5.2. Связь суммы по состояниям с термодинамическими функциями ……………………………….30 5.3. Константа равновесия реакции ХИО ……………………….32 5.4. Определение коэффициента разделения реакции ХИО с использованием β - факторов …………………...39 5.5. Метод Бигеляйзена – Майер для расчета коэффициента разделения реакции ХИО……….………………..41 6. Коэффициент разделения реакции ХИО в гетерогенных системах …………………………………………….44 7. Особенности термодинамики реакций изотопного обмена с участием водорода …………………………………………47 7.1. Концентрационная зависимость коэффициента разделения …………………………………………………………47 7.2. Связь между коэффициентами разделения для бинарных изотопных смесей ………………………………...53 7.3. Распределения трития между равновесными фазами в трехизотопных смесях протий – дейтерий – тритий ………….55 8. Экспериментальные методы определения коэффициента разделения …………………………………………...57 8.1. Измерение однократного эффекта разделения……………...58 8.2. Методы определения коэффициента разделения, основанные на умножении однократного изотопного эффекта..62 Глава 2. Особенности кинетики реакций изотопного обмена 9. Кинетика реакций ХИО при значении коэффициента разделения, близком к 1 ……………………………………………..69 10. Кинетика реакций ХИО при значении коэффициента разделения, значительно отличающемся от 1………………………73 11. Особенности кинетики реакций ХИО в гетерогенных системах……………………………………………..76 Заключение ………………………………………………………………….78 Библиографические ссылки………………………………………………...79
Введение Стабильные изотопы различных элементов в настоящее время находят все более широкое применение в самых разнообразных областях науки и техники – от биологии и медицины до крупномасштабной ядерной и термоядерной энергетики. Наиболее масштабное применение среди этих изотопов нашли изотопы легких элементов – водорода, лития, бора, углерода, азота, кислорода. Годовой масштаб производства, например, тяжелой воды (21Н2168О) достигал 5000 т, потребности в других изотопах составляют десятки и сотни килограммов в год. Представляется целесообразным привести некоторые сведения из истории открытия изотопов. Термин «изотоп» (от греческого isos – одинаковый и topos – место) был введен в 1910 году английским физиком Фредериком Содди. Это термин появился в научной литературе раньше экспериментального открытия явления изотопии. Первым элементом, для которого экспериментально были обнаружены изотопы, был инертный газ неон. В 1913 году английский физик Джозеф Джон Томсон, проводя эксперименты по исследованию так называемых «каналовых лучей» с использованием созданного им прототипа современных аналитических приборов – масс-спектрометров, экспериментально обнаружил изотопы неона – 2010Ne и 2210Ne. В период с 1913 по 1935 год, в основном, благодаря созданному Френсисом Астоном более совершенному масс-спектральному прибору, состоялось открытие всех основных стабильных изотопов элементов и определение их относительной распространенности в природе. В табл. 1 приведены даты открытия изотопов некоторых легких элементов, имеющих в настоящее время практическое применение. Указанные в таблице величины концентраций изотопов в природной смеси относятся ко времени их открытия и, для ряда изотопов, несколько отличаются от уточненных в более поздний период. Таблица 1
|
||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 211; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

 УДК 621.039.33:544.341-42
УДК 621.039.33:544.341-42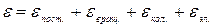 , (5.1)
, (5.1)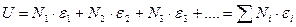 , (5.2)
, (5.2)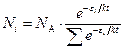 . (5.3)
. (5.3)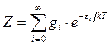 , (5.4)
, (5.4)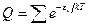 . Учитывая уравнение (5.1) и очевидное математическое соотношение ea + b + c = ea . eb . ec, получим следующее выражение для суммы по состояниям отдельной молекулы:
. Учитывая уравнение (5.1) и очевидное математическое соотношение ea + b + c = ea . eb . ec, получим следующее выражение для суммы по состояниям отдельной молекулы: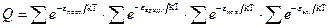 , (5.5)
, (5.5)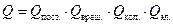 . (5.6)
. (5.6)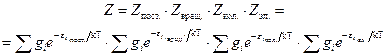 . (5.7)
. (5.7)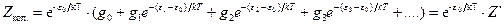 . (5.8)
. (5.8) Учебное издание
Учебное издание


