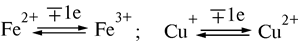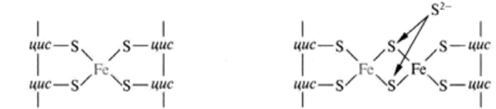Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты, катализирующие окислительно-восстановительные реакции в ходе биологического окисления.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
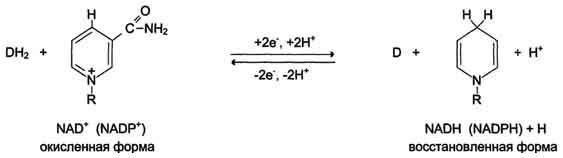
Ферменты, катализирующие окислительно-восстановительные реакции относятся к классу оксидоредуктаз. Окидоредуктазы – I класс ферментов, относящиеся к сложным белкам, т.к. являются двухкомпонентными молекулами, коферментами которых являются моно- и динуклеотиды (производные витаминов РР и В2 – НАД+, НАДФ+, ФАД, ФМН), производные протопорфиринов (гем), хиноны, ионы металлов, дигидробиоптерин. Коферменты всех оксидоредуктаз играют роль промежуточных акцепторов электронов. Оксидоредуктаза с восстановленным коферментом не может участвовать в катализе реакции до тех пор, пока электроны ее кофермента не будут переданы на конечный акцептор. Отношение восстановленный кофермент/окисленный кофермент является важным фактором, регулирующим окислительно-восстановительные реакции в клетке. В зависимости от типа конечного акцептора все окислительно-восстановительные реакции можно разделить на аэробные (конечный акцептор кислород) и анаэробные (конечный акцептор не кислород, а др. соединения). По способу передачи электронов, которым пользуются оксидоредуктазы, различают: · дегидрогеназы – катализируют реакции дегидрирования (отщепления водорода); · оксидазы – катализируют реакции присоединения электронов к кислороду; · оксигеназы (гидроксилазы) – катализируют внедрение атома кислорода по С-Н связи субстрата (создание гидроксильной группы); · гидропероксидазы – способствуют образованию перекиси водорода в фагоцитарных и др. клетках. НАД+ и НАДФ+ представляют собой коферменты большого числа дегидрогеназ; связь между ними и апоферментом непрочная, и они ассоциируют между собой только в момент реакции. Дегидрогеназы данного типа катализируют перенос гидрид-иона (второй протон остается в среде). В присутствии восстановленного субстрата (DH2) – донора электронов и соответствующей дегидрогеназы пиридиновое кольцо восстанавливается путем связывания в четвёртом положении одного протона (гидрид-иона) и двух электронов, второй протон остаётся в среде:
НАД+-зависимые дегидрогеназы локализованы в основном в матриксе митохондрий. Их окисление осуществляется I комплексом дыхательной цепи (см. ниже) – НАДН:КоQ – оксидоредуктазой. НАДФ+-зависимые дегидрогеназы – это преимущественно цитоплазматические ферменты, и их восстановленные формы являются донорами восстановительных эквивалентов в реакциях биосинтеза.
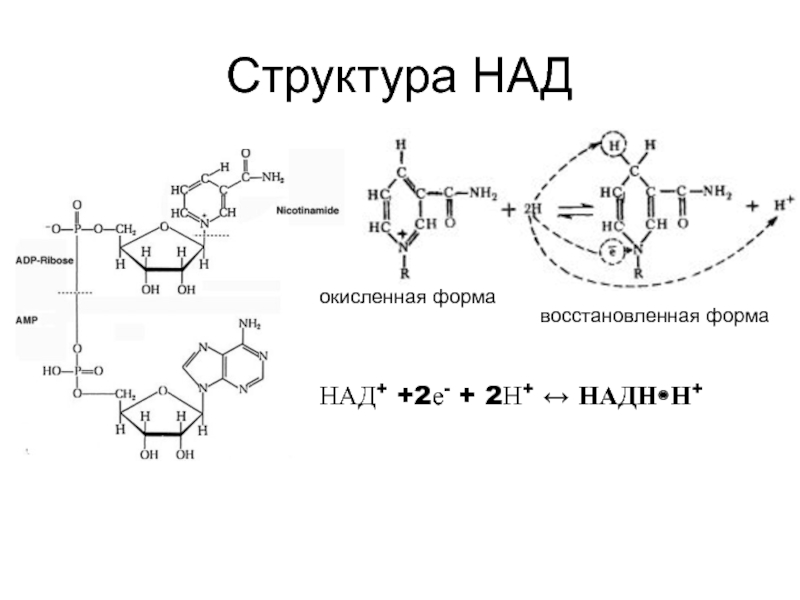
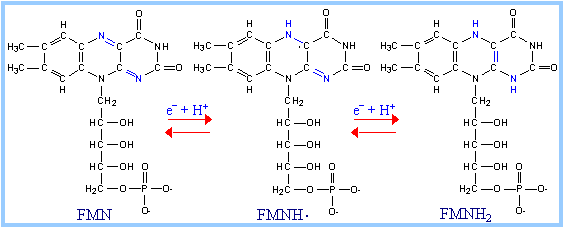
Таким образом, незначительные различия в структуре НАД+ и НАДФ+ (НАД+ построен из двух мононуклеотидов, один из которых – адениловая кислота, а во второй входят остатки никотинамида (витамина РР), рибозы и фосфата; в молекуле НАДФ+ имеется дополнительная фосфатная группа, присоединенная к С2ʹ атому рибозы адениловой кислоты кофермента) не отражаются на механизме их участия в переносе электронов, но придают им разные функции в клетке: · восстановленная форма НАДН•Н+ поставляет электроны в реакции, обеспечивающие образование макроэргов; · НАДФН•Н+ - для анаболических процессов (восстановительные синтезы) или для реакции обезвреживания ксенобиотиков и активных форм кислорода. ФМН и ФАД обладают способностью передавать электроны прямо на кислород. Такие дегидрогеназы получили название оксидаз. Коферменты прочно связаны с апоферментом, выступая в роли простетической группы, а не свободно диссоциирующих коферментов. Обе группы представляют собой метаболически активную форму рибофлавина (витамина В2). В отличие от НАД+/НАДФ+ - зависимых дегидрогеназ (которые одновременно переносят два электрона), коферменты флавиновых дегидрогеназ могут переносить и по одному, и по два электрона. Принимая один электрон, связанный с ферментом ФМН, превращается в радикал семихинона, который может присоединять второй электрон с образованием полностью восстановленной формы ФМНН2. Способность принимать один или два электрона придает флавинзависимым дегидрогеназам важное качество: они могут связывать между собой переносчиков двух электронов (НАДФН•Н+) с одноэлектронными переносчиками (например, Fe3+, входящими в состав железо-серных белков дыхательной цепи):
a) НАДН•Н+ + ФМН → НАД+ + ФМНН2; b) ФМНН2 + Fe3+ → ФМНН• + Fe2+ + Н+, после того, как Fe2+ окислится следующим акцептором, ФМН передаст ему фторой электрон: ФМНН• + Fe3+ → ФМН + Fe2++ Н+.
Итак, флавинзависимые дегидрогеназы, в отличие от никотинзависимых, обладают способностью непосредственно передавать электроны прямо на кислород (поэтому являются оксидазами). Результатом передачи является образование перекиси водорода (Н2О2).
Хиноны (коэнзим Q, убихинон). Коэнзим Q (КоQ) – это небольшая молекула, производное бензохинона с длинной боковой цепь, которая в большинстве тканей млекопитающих и человека состоит из 10 изопреновых единиц (КоQ10). Установлено, что убихинон играет роль промежуточного переносчика водородных атомов, т.е. электронов и протонов в митохондриальной мембране от I и II комплексов дыхательной цепи, окисляя восстановленную форму флавиновых ферментов, а также способен захватывать протоны из матрикса, превращаясь в восстановленную форму КоQН2. Он может передвигаться в липидной фазе мембраны (продольно и латерально) и передавать 1 е- или 2 е- к другим ферментам дыхательной цепи, получивших название цитохромов, а протоны высвобождаются в межмембранное пространство митохондрий.
Запомните! До Ко Q был 2-х электронный перенос, после Ко Q – одноэлектронный.
Как всякий хинон КоQ может существовать в окисленной и восстановленной формах (гидрохинон):
Цитохромы.
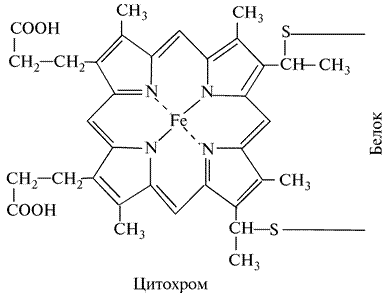
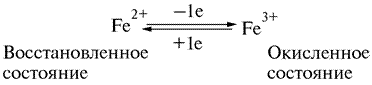
В 1925 г. Кейлиным была открыта ещё одна группа переносчиков электронов – цитохромы. Это электронпереносящие белки-фермены, молекула которых содержит гем и гемоподобные структуры в качестве простетической группы. В отличие от дегидрогеназ, они переносят по одному электрону. Исполнительным элементом в цитохромах является атом железа, способный менять свою валентность:
Цитохромы относятся к одноэлектронным окислительно-восстановительным соединениям. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов. Известно около 30 различных цитохромов, которые в зависимости от способности поглощать свет разделяются на группы, обозначаемыми строчными английскими буквами (a, b, c и т.д.). внутри каждой группы отдельные виды цитохромов обозначаются цифровыми индексами – b 1, b 2, b 5 и т.д. Цитохромы различаются: 1. по радикалам в порфириновом кольце; 2. по строению апофермента; 3. по типу связи просетической группы с апоферментом. Цитохромы располагаются в митохондриальной цепи между убихиноном и кислородлом в определенной последовательности: b → c 1 → c → aa 3 Цитохромы b, c 1 и c выполняют функцию промежуточных переносчиков электронов, а комплекс цитохромов aa 3, который называется цитохромоксидазой, является терминальным дыхательным ферментом, непосредственно взаимодействующий с кислородом. В цитохроме a простетическая группа через пятую координационную связь железа соединяется с аминогруппой аминосахара, входящего в апофермент, а шестая координационная связь остается свободной. При переносе электрона валентность атома железа меняется: Fe3+ ↔ Fe2+. К шестой координационной связи железа цитохрома a могут присоединяться такие группировки атомов, как HCN, H2S, CO. При этом валентность железа становится постоянной (Fe3+) и поток электронов прекращается. На этом основан механизм действия дыхательных ядов. Цитохромоксидза (комплекс aa 3) состоит из 6 субъединиц (2 –и 4 - a 3). В цитохроме a 3 имеются атомы меди (Cu2+). Электроны принимаются субъединицами a и передаются цитохрому a 3, который передает их далее на кислород. Перенос электронов комплексом aa 3 включает следующие реакции:
Окисленная форма цитохрома a (Fe3+) принимает электроны от восстановленного цитохрома c, переходя в восстановленную форму (Fe2+), которая затем вновь окисляется в Fe3+ передавая электроны на атомы Cu2+ цитохрома a 3. Этот процесс также сопровождается изменением валентности меди. Атом кислорода, локализованный в углублении цитохрома a 3 с матричной стороны, заряжается отрицательно и приобретает способность взаимодействовать с 2-мя протонами водорода из матрикса, в результате чего образуется молекула воды.
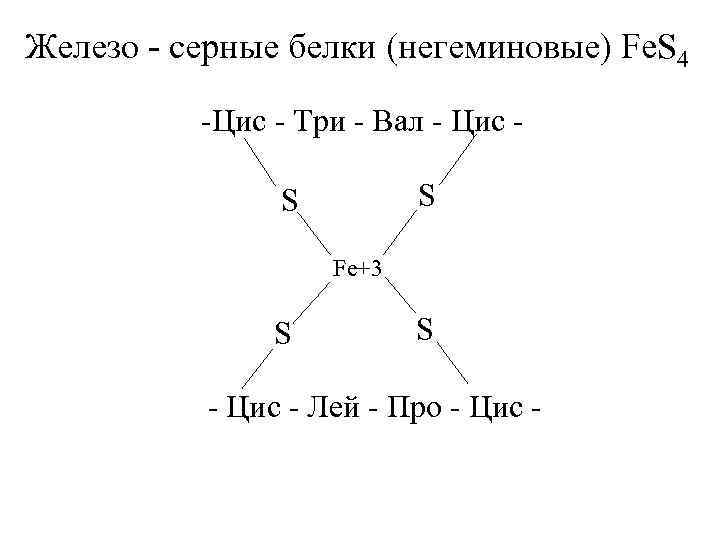
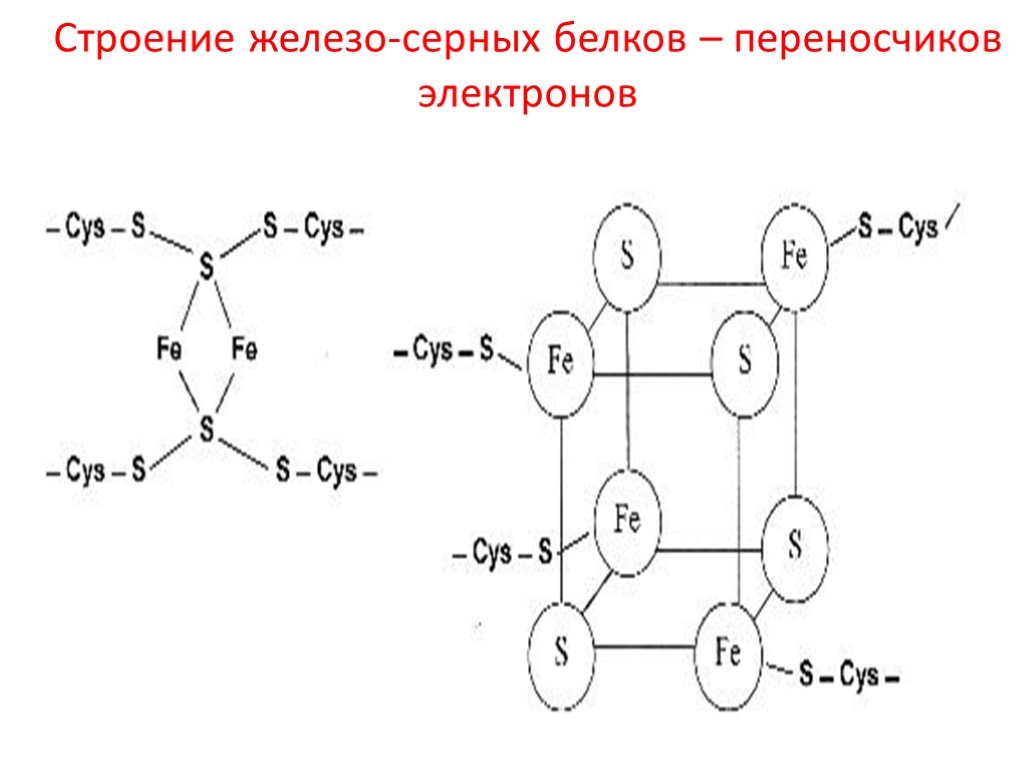
Fe-S белки. Кроме железа, входящего в состав цитохромов, в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий при помощи ферментов ЦПЭ, принимают участие еще одна группа белков, получивших название железо-серных белков (или комплексов). Они входят в состав I, II и III комплексов дыхательной цепи (см.ниже), выполняя роль второй простетической группы в процессе транспорта электронов. Их основная функция – «ловушка электронов». Железо в их составе – негемовое (негеминовые), поэтому их назвали негемовыми железопротеинами.
Атомы железа связаны координационными связями с 4-мя атомами серы 4-х цистеиновых остатков в белке (S2-).
Эти белки играют важную роль в соединении 2-х электронных переносчиков с 1-о электронными в ЦПЭ.
Перечисленные выше белки и ферменты (кроме цитохромоксидазы) используют три из четырех механизмов переноса электронов: 1. перенос электронов (цитохромы и FeS – белки); 2. перенос электронов в составе гидрид-ионов (НАД+ - зависимые дегидрогеназы); 3. перенос электронов в составе атомов водорода (ФМН, ФАД-зависимые дегидрогеназы). БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ Биологическое окисление – процесс окисления протонов водорода молекулярным кислородом с образованием эндогенной воды. В настоящее время биологическое окисление определяется как совокупность реакций окисления и восстановления. Вещество окисляется если теряет электроны (е-), или одновременно электроны и протоны, или присоединяет кислород. Противоположный процесс называется восстановлением. Субстраты окисления, отдающие электроны, называются донорами электронов. Электроны, при участии промежуточных переносчиков (ферментативных комплексов, локализованных на внутренней мембране митохондрий), передаются на кислород – конечный (терминальный) акцептор электронов у аэробных организмов. Одновременно с процессами отщепления электронов от субстратов и присоединения их к кислороду в биологических системах происходит образование (синтез) молекул АТФ. Данный процесс, также, локализован в митохондриях, на внутренней мембране, но в грибовидных выростах, где имеется специфический для данной реакции фермент – АТФ-синтаза.
Т.о., процессы биологического окисления тесно связаны с процессами окислительного фосфорилирования (в результате которых синтезируются молекулы АТФ).
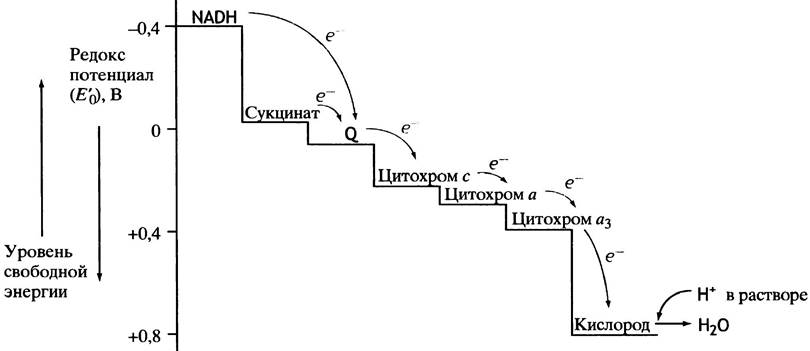
Известны четыре основных механизма биологического окисления: 1. дегидрирование субстратов – путем отнятия двух атомов водорода; 2. дегидрирование субстратов – путем отнятия гидрид-иона (:Н-), с высвобождением свободных протонов; 3. путем присоединения кислорода к субстратам окисления; 4. путем отнятия только электронов. Способность молекул отдавать электроны другой молекуле определяется окислительно-восстановительным потенциалом (ОВП или редокс - потенциалом). Редокс - потенциал определяют путем измерения электродвижущей силы в вольтах. В качестве стандарта принят редокс-потенциал водорода: Н2 2Н+ + 2е-; ОВП = -0,42В Запомните! ü Чем меньше потенциал окислительно-восстановительной системы, тем легче она отдает электроны и в большей степени является восстановителем. ü Чем выше потенциал окислительно-восстановительной системы, тем сильнее выражены ее окислительные свойства, т.е. способность принимать электроны присуща только молекулам с более высоким редокс-потенциалом. Это правило лежит в основе последовательности расположения ферментативных систем цепи переноса электронов – промежуточных переносчиков электронов от протонов водорода до кислорода.
Т.о., транспорт высокоэнергетических электронов восстановленных субстратов происходит в сложной системе, состоящей из окислительно-восстановительных ферментов и коферментов, локализованных на внутренней мембране митохондрий. Ферменты переноса протонов и электронов относятся к классу оксидоредуктаз. Фермент, участвующий в процессах синтеза АТФ – к классу синтаз (АТФ-синтаза). В митохондриях поток электронов устремляется от субстрата, содержащего водород, к молекулярному кислороду. Реакция соединения водорода с кислородом протекает со взрывом («гремучий газ»), т.к. сопровождается выделением большого количества тепла (энергии) – до 239 кДж/моль. В этой реакции водород отдает свои электроны (окисляется), а кислород присоединяет электроны (восстанавливается). Однако в клетках живого организма эта реакция протекает без взрыва (иначе сам процесс существования живой системы был бы невозможен). Почему? Потому что происходит поэтапное выделение энергии в межмембранное пространство митохондрий, где скапливаются протоны водорода, несущие заряд (+). Поэтому, биологическое окисление отличается от реакции образования гремучего газа следующими характеристиками: 1) постепенным выделением энергии; 2) окисляется не молекулярный водород, а водород, включенный в состав субстратов (SH2); 3) энергия высвобождается не только в идее тепла, но и аккумулируется в виде электрохимического потенциала и АТФ. Реакция образования воды протекает не одномоментно, она состоит из большого числа связанных друг с другом реакций, составляющих реакционную цепь. Эта цепь начинается с отрыва водорода субстрата и заканчивается переходом электронов на кислород, поступающий с вдыхаемым воздухом, а переносчиками электронов и протонов водорода являются ферменты дыхательной цепи – оксидоредуктазы.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 1149; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.124.24 (0.011 с.) |