Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разберем аккумуляторы энергии в организме.
1. Внутренняя мембрана митохондрий. Это промежуточный аккумулятор энергии при получении АТФ. За счет энергии окисления веществ происходит выталкивание протонов из матрикса в межмембранное пространство митохондрий (см. далее – цепь переноса электронов). В результат создается электрохимичесий потенциал. При разрядке мембраны энергия электрохимического потенциала трансформируется в энергию АТФ: Еокисл → Еэпх → ЕАТФ
Для реализации этого механизма внутренняя мембрана митохондрий содержит ферментативную цепь переноса электронов на кислород и аденозинтрифосфатазу зависимую (протонзависимую синтазу АТФ).
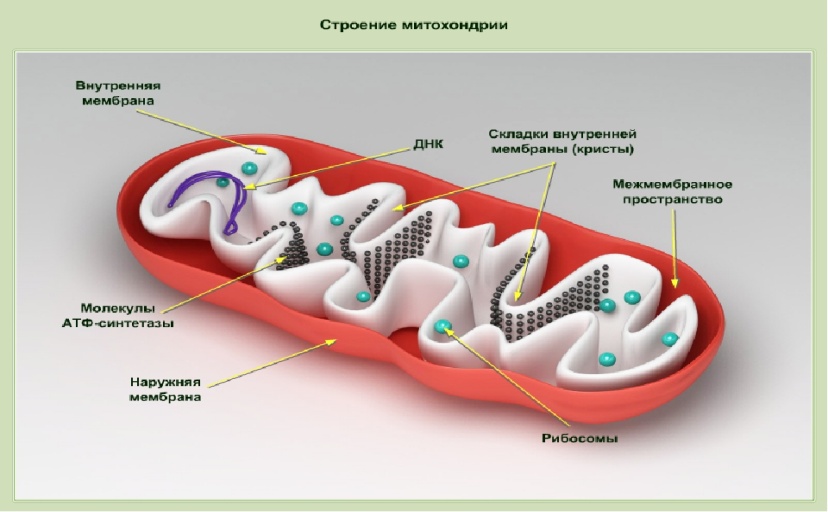
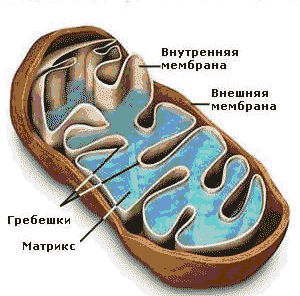
Строение митохондрий.
Митохондрии – внутриклеточные компоненты чаще палочковидной (овальной) формы, но могут встречаться и иные формы, например округлые, звездчатые, число которых в клетке составляет сотни или тысячи (число митохондрий может меняться в зависимости от стадии развития клетки и ее функциональной активности).
Внешняя мембрана митохондрий (гладкая) отграничивает внутреннее пространство; проницаема для О2 и ряда низкомолекулярных соединений; содержит ферменты метаболизма липидов и моноаминов (например, ферменты, участвующие в удлинении молекул насыщенных жирных кислот, ферменты, катализирующие окислительные процессы, не связанные с синтезом АТФ (например, моноаминооксидаза и др). Моноаминооксидаза служит маркерным ферментом для идентификации наружной мембраны. Межмембранное пространство содержит аденилатциклазу (АТФ + АДФ ↔ 2 АТФ) и ферменты фосфорилирования АДФ, не связанные с дыхательными цепями. Кроме аделитациклазы межмембранное пространство содержит нуклеозиддифосфаткиназу. Внутренняя мембрана митохондрий (содержит кристы, или складки, на которых имеются дополнительные грибовидные выросты, где локализована АТФ-синтаза) содержит большое количество ферментов, 30% которых составляют ферменты дыхательной цепи и окислительного фосфорилирования. Проницаема для малых молекул (О2 и мочевины). Маркерным ферментом для идентификации внутренней мембраны является цитохромоксидаза. Матрикс митохондрий одержит ферменты ЦТК, β-окисления жирных кислот, синтеза мочевины, аспартатаминотрансферазу (АсАТ), глутаматдегидрогеназу, фосфоеноилпируваткарбоксикиназу, и т.д. Маркерными ферментами для идентификации внутренней мембраны являются глутаматдегидрогеназа и малатдегидрогеназа.
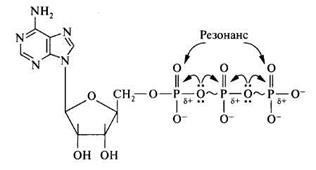
2. АТФ и другие макроэргические соединения. Материальным носителем свободной энергии в органических веществах являются химические связи между атомами. Обычным энергетическим уровнем возникновения или распада химической связи является ≈ 12,5 кДж/моль. Однако имеется ряд молекул, при гидролизе ангидридных и сложноэфирных связей которых выделяется более 21 кДж/моль энергии – макроэргические соединения ( АТФ, ГТФ, УТФ, ЦТФ, ТТФ, креатинфосфат, некоторые тиоэфиры (ацил-КоА), фосфоеноилпируват, 1,3 дифосфоглицерат и др). Из всех известных в настоящее время макроэргических соединений ключевой молекулой в биоэнергетике является АТФ. Почему? Для ответа на этот вопрос надо рассмотреть структуру АТФ. Молекула АТФ представляет собой термодинамически нестойкое соединение. Её нестабильность определяется следующими факторами: 1) электростатическим отталкиванием в области кластера одноимённых отрицательных зарядов, что приводит к напряжению всей молекулы АТФ, но больше всего в месте расположения связи: – Р – О – Р –; 2) конкурентным резонансом, т.к. между атомами фосфора существует конкуренция за неподеленные подвижные пары электронов атома кислорода, расположенного между двумя молекулами фосфора, поскольку на каждом атоме фосфора имеется частичный положительный заряд.
Таким образом, возможность существования АТФ определяется наличием достаточной химической энергии в молекуле, позволяющие компенсировать эти физико-химические напряжения. В молекуле АТФ имеются две пирофосфатные (фосфоангидридные) связи, гидролиз которых сопровождается значительным уменьшением свободной энергии (при рН=7,0 и t=370). Связи, при гидролизе которых изменения свободной энергии системы составляют более 30 кДж/моль, в биохимии называют макроэргическими и обозначают знаком ~ (тильда), а соединения, обладающие такими связями макроэргами. Образование макроэргических соединений в большинстве случаев зависит от энергии, поставляемой АТФ.
Следовательно, центральное место в энергетическом обмене занимает цикл: АТФ ↔ АДФ + Р н
В клетках теплокровных АТФ возникает 2-мя путями: 1) аккумулирует энергию более энергоёмких соединений, стоящих выше АТФ в термодинамической шкале без участия О2 – субстратное фосфорилирование: S~Р + АДФ S + АТФ; 2) аккумулирует энергию электрохимического потенциала при разрядке внутренней мембраны митохондрий – окислительное фосфорилирование (Еокис → Еэпх → ЕАТФ). В клетке АТФ выполняет свою биологическую роль в виде комплекса с ионами Mg2+ или Mn2+. Это повышает энергию гидролиза макроэргической связи АТФ до 52,5 кДж/моль. Высвобождение энергии тоже идёт двумя путями: АТФ + Н2О → АДФ + Рн + Н +, ∆G0ʹ = - 31,0 кДж/моль где Рн – фосфор неорганический (ортофосфат), ∆G0ʹ - свободная энергия (знак «-» уменьшение свободной энергии;
АТФ + Н2О → АМФ + РРн + Н +, ∆G0ʹ = - 31,9 кДж/моль где РРн – пирофосфат;
Во время интенсивных упражнений скорость использования АТФ может достигать 0,5 кг/мин. Если ферментативная реакция термодинамически не выгодна, то она может осуществляться при сопряжении с реакцией гидролиза АТФ. Гидролиз молекулы АТФ изменяет равновесие отношение субстратов и продуктов в сопряженной реакции в 108 раз. 3. НАДФН+Н+ (НАДФН2). Никотинамидадениндинуклеотидфосфат (восстановленный) – это специальный аккумулятор с высокой энергией, кторый используется в клетке (локализация – цитозоль) для биосинтезов, например, при обезвреживании ксенобиотиков – чужеродных веществ, попадающих в организм извне. С их помощью происходит введение ОН-групп в субстрат окисления (ксеноботик), который как правило, обладает признаком гидрофобности: S - CH 3 + НАДФН2 + О2 → S - CH 2 ОН + Н2О + НАДФ+, где S-CH3 – гидрофобный субстрат (ксенобиотик). ФАЗЫ ВЫСВОБОЖДЕНИЯ ЭНЕРГИИ 1. Расщепление полимеров до мономеров (энергия не выделяется): белки распадаются до аминокислот, жиры – до жирных кислот и глицерола, полисахара (углеводы) – до моносахаров (глюкоза). 2. Специфические пути превращения мономеров в общие продукты (выделяется до 20% энергии): из аминокислот образуются промежуточные продукты распада – сукцинат, фумарат, ПВК, α-кетоглютарат, ЩУК (или оксалоацетат), ацетил-КоА; из жирных кислот – ацетил-КоА, из глицерола – вначале ПВК, а затем ацетил-КоА; из глюкозы – ПВК, а затем – ацетил-КоА. Как видим, универсальным метаболитом белков, жиров и углеводов явлется молекула ацетил-КоА. 3. Общие пути катаболизма (ЦТК) и сопряженные с ней цепи переноса электронов (выделяется до 80% энергии: в этой фазе (протекает в митохондриях) из субстратов окисления извлекаются атомы водорода, которые передаются на кислород с образованием эндогенной воды и выделением энергии. Эта энергия рассеивается в виде тепла и примерно на 40% запасается в виде АТФ и других макроэргических соединений.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.134.29 (0.006 с.) |