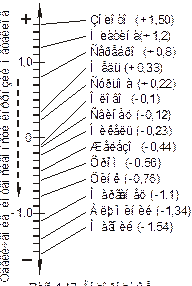Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Антикоррозионная защита металлов и сплавовСодержание книги
Поиск на нашем сайте
Металлы, как и растения, животные и люди, тоже «болеют». Это не только износ рабочих поверхностей и деформации (температурные и силовые) деталей, но и самая опасная «болезнь» строительных и машиностроительных конструкций — коррозия металлов.

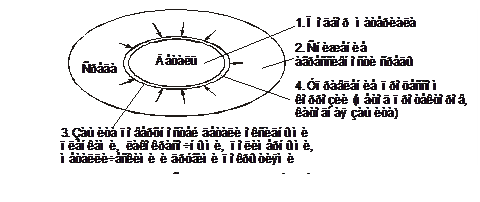
Общеизвестен закон природы: из двух состояний с большей вероятностью реализуется то, которое более устойчиво и стабильно. Металлы в природе находятся в виде химических соединений с кислородом, серой и другими химическими элементами (Fe 3 O 4, Fe 2 O 3, FeO, Al 2 O 3…). Мы извлекаем технически чистый металл из этих окислов, далее получаем сплавы металла, из которых изготовляем различные детали, машины и сооружения, а природа путем коррозии металлических изделий вновь небезуспешно возвращает все на круги своя — к окислам и другим природным химическим соединениям. За всю историю человечества добыто около 20 млрд. тонн железа, около 6 млрд. его находится сейчас в машинах и строительных конструкциях, а 14 млрд. тонн уже съедено ржавчиной, т. е. утеряно для человека. На ремонт корродированных машин и строительных конструкций, на замену труб водопровода, отопления, на антикоррозийную защиту и профилактику коррозии затрачивается много времени и труда. В итоге около 30 % ежегодно производимого металла расходуется на восстановление потерь от коррозии. Различают два вида коррозии: химическую и электрохимическую. Процесс коррозии определяется тремя видами факторов (рис. 8.9): химической природой и структурой металла или сплава, из которого изготовлена деталь; содержанием агрессивных веществ в окружающей среде и температурой среды.
Химическая коррозия — это разрушение металлов под воздействием высокотемпературных газов или жидкостей (без электролиза). При высоких температурах образуется нагар на клапанах и головках блока цилиндров, на свечах зажигания, на поршнях (верхней части юбки и поршневых канавках), на компрессионных кольцах, на арматуре печей и на тепло- и электронагревателях. Сначала на поверхностях деталей при температурах до 150° С образуются лаковые покрытия, далее при более высоких температурах появляется нагар. Электрохимическая коррозия проходит в жидких средах, проводящих электрический ток; в процессе ее происходит электролитическое разрушение металла. Одним из условий для возникновения электрохимической коррозии является наличие воды. Вода есть в атмосфере, в грунте, на поверхностях деталей и конструкций. В почве, воздухе и рабочих средах также имеются окислы и кристаллы солей, сернистые и выхлопные газы и, в итоге, образуются кислоты — это третье условие появления коррозии. Таким образом, для возникновения процесса электрохимической коррозии необходимы три условия: — наличие разных металлов, т. е. металлов или отдельных фаз с отличающимся водородным потенциалом; — наличие воды; — наличие солей, кислот. Атомы металлов при контакте с электролитом переходят в раствор в виде ионов. Переход атомов металлов в ионы, т. е. растворение металлов (коррозия), определяется величиной нормального электродного потенциала, который представляет собой величину напряжения (В) электрического тока, которое нужно приложить к границе раздела фаз металл–жидкость, чтобы воспрепятствовать переходу иона металла в раствор. Чем больше отрицательное значение потенциала (-), тем больше металл стремится к растворению в электролитах, тем интенсивнее идет коррозия. Из рис. 8.9 видно, что уменьшение коррозии возможно при подборе материала детали; снижении агрессивности среды; создании защитных пленок и управлении процессом коррозии. Методы защиты от коррозии определяются необходимостью нейтрализации факторов (рис. 8.11), определяющих интенсивность коррозии (подбор антикоррозийных материалов; снижение агрессивности и температуры среды; отделение поверхности детали от агрессивной среды; целевое управление процессом коррозии). 1. Подбор материала детали выполняется исходя из водородного потенциала металла. Так, из рис. 8.10 видно, что изделия из золота, платины и серебра более коррозийностойкие, чем изделия из железа, цинка и алюминия, но эти материалы дорогие, поэтому находят ограниченное применение в быту и технике. Химически чистые металлы имеют более высокие антикоррозионные свойства, чем сплавы. Так, «демидовское железо», выплавляемое на древесном угле из хороших руд, практически не ржавеет, а современный листовой прокат нельзя использовать без защитных покрытий. В противовес использованию химически чистых металлов добавки некоторых легирующих элементов, в основном в больших количествах C r и Ni, позволяют получить так называемые нержавеющие стали (12Х18Н10Т, 12Х18Н9, 08Х22Н6Т и др.).
 ерхности детали относительно быстро образуются прочные и стойкие защитные пленки, поэтому алюминиевые детали не требуют дополнительной защиты (покраски и др.) от коррозии. ерхности детали относительно быстро образуются прочные и стойкие защитные пленки, поэтому алюминиевые детали не требуют дополнительной защиты (покраски и др.) от коррозии.
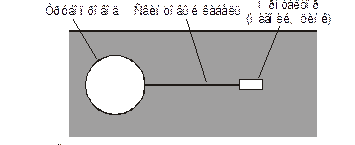
2. Снижение агрессивности среды выполняется путем добавки антиокислительных присадок в смазочное масло и топливо и в системы охлаждения. Для систем отопления проводится предварительная подготовка воды (удаление солей и железа). Немаловажным фактором является снижение температуры теплоносителя. Например, для системы отопления снижение температуры со 100…110° С до 60…70° С, естественно, приведет не только к снижению тепловых потерь, но и к уменьшению коррозии элементов системы. 3. Покрытия поверхностей деталей могут выполнять следующие задачи: отделение материала детали от агрессивной среды; замыкание гальванической электрической цепи не через агрессивную среду, а через металлическое покрытие и, в результате, прекращение электрохимической коррозии; «жертвование» материала покрытия (в основном Zn) на коррозионное разрушение и тем самым снижение коррозии основного материала детали. Покрытия наносятся на поверхности деталей (хром и никель), посуду (эмаль), жесть и трубы (цинк), консервные банки (олово) и днища (лужение кузовов) легковых автомобилей, например, автомобилей М20 «Победа». В настоящее время для изготовления днищ кузовов используются неметаллические (полимерные) и биметаллические (цинковые) покрытия. Металл наносят с помощью электрогальванических процессов (осаждение никеля, хрома, цинка) или металлизации. Гальваническое покрытие обеспечивает хорошее сцепление с основным металлом, но требует технологически сложной подготовки поверхностей и высокой культуры производства. 4. Метод защиты металлов протекторами (рис. 8.12)
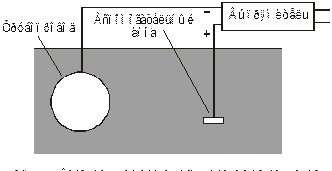
5. Способ катодной защиты внешним током (рис. 8.13) металлических конструкций, судов и магистральных трубопроводов впервые был применен в 1910 году для защиты от коррозии подземных конструкций. Этот способ отличается от метода протекторов тем, что к защищаемой детали подводится отрицательный потенциал от источника питания, а положительный — к вспомогательному аноду. В случае «естественной» коррозии деталь «теряет» электроны, а так как здесь, наоборот, электроны подводятся к детали, то и не происходит процесса ее коррозии.
Одной из основных технологических операций защиты деталей строительных конструкций и машин от коррозии является окраска (рис. 8.14), предназначенная не только для защиты от коррозии, но и для эстетических целей.

Лакокрасочное покрытие может наноситься следующими способами: 1—ручная окраска кистью; 2 — окраска погружением детали в ванну с краской; 3 — нанесение краски воздушным распылением; 4 — нанесение краски безвоздушным распылением; 5 — окраска в электростатическом поле. Воздушное распыление проводится с помощью пистолетов-распылителей в специальных камерах или помещениях, оборудованных вентиляционными установками. Краска подается под давлением сжатого воздуха или сил тяжести. Смешивание может выполнятся как внутри пистолета, так и снаружи. Наилучшие результаты получаются при наружном смешивании. Недостатками воздушного распыления являются большие потери краски (до 40…50 %), взрывоопасность лакокрасочного тумана, вредность для организма. В целях экономии растворителя, который нужен в основном для снижения вязкости краски и который улетучивается при сушке, рационально для уменьшения вязкости краски нагревать ее до 60° С. При этом толщина одного слоя увеличивается в 1,5…2 раза по сравнению с окраской без подогрева, следовательно, необходимо наносить меньше слоев, что способствует большей производительности окраски. При безвоздушном распылении предварительно подогретая краска подается насосом под давлением 40…60 кгс/см2 через распылитель. При этом расход краски уменьшается на 20…25 % по сравнению с воздушным распылением. Наиболее эффективной является окраска в электростатическом поле (рис. 8.15). Однако необходима предварительная окраска внутренних поверхностей и глубоких впадин. Кроме того, часть краски, не получив заряда, теряется. Почти 100 - процентное использование краски получается при электромеханическом распылении, когда отрицательный заряд высокого напряжения сообщается не промежуточной среде (воздуху), а непосредственно краске.
Сушка покрытий заключается в удалении летучих веществ для нитроэмалей, а у синтетических эмалей и масляных покрытий после удаления летучих веществ происходит окисление и полимеризация связывающих веществ. Скорость сушки определяется температурой покрытия и степенью подвижности воздуха. При неподвижном воздухе пограничный слой воздуха насыщается парами растворителя, и дальнейший процесс его испарения замедляется. Различают по способу подачи тепла конвекционную
При терморадиационной сушке источником тепла являются невидимые инфракрасные лучи, которые свободно проходят через слой покрытия и нагревают металл. Испарение растворителя и образование корки начинается с нижней части слоя, тем самым создаются хорошие условия для В качестве источников инфракрасного излучения применяются термоизлучатели, нагреваемые электрическим током или газом. Панели излучателей нагреваются до 400…500° С и излучают инфракрасные лучи с длиной волны 3…5 мкм, которые легко проходят слой краски и, поглощаясь металлом, нагревают его.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.228.171 (0.013 с.) |