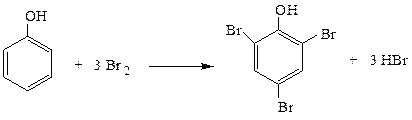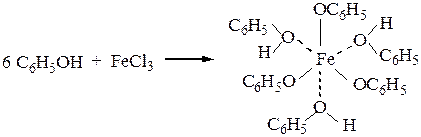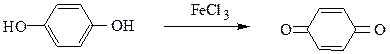Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4.10 Взаимодействие спирта с серной кислотойСодержание книги
Поиск на нашем сайте
Реактивы, материалы, приборы: изоамиловый спирт, серная кислота (ρ=1,84 г/см3), пробирки, капельницы.
В пробирку приливают 4 капли концентрированной серной кислоты, затем при осторожном встряхивании и охлаждении добавляют 2 капли изоамилового спирта. Полученную однородную жидкость оставляют стоять 3 мин. Затем 3-4 капли продукта реакции помещают в пробирку с 5 каплями воды. Образуется прозрачный, не имеющий запаха раствор изоамилсерной кислоты.
(С H3)2CH СН 2 СН 2 –OH + Н 2 S О 4 ¾ ® (С H3)2CH СН 2 СН 2 –OSO3H + H2O
Наблюдение:
Выводы:
Опыт 4.11 Бромирование фенола
Реактивы, материалы, приборы: 1%-й раствор фенола, бромная вода, пробирки, мерные пробирки.
К 1 см3 1%-го раствора фенола добавляют 3-4 см3 насыщенного раствора брома в воде. Выпадает белый осадок 2,4,6-трибромфенола с характерным запахом.
Наблюдение:
Выводы:
Опыт 4.12 Реакции фенолов с хлоридом железа (III)
Реактивы, материалы, приборы: 0,1 н. раствор хлорида железа (III), 1%-е спиртовые растворы фенола, пирокатехина, резорцина, гидро-хинона, пирогаллола и α-нафтола, пробирки, капельницы.
Берут шесть пробирок. В первую пробирку вносят 3 капли 1 н. раствора фенола, во вторую – 3 капли раствора пирокатехина, в третью – резорцина, в четвертую – гидрохинона, в пятую – пирогаллола, в шестую – α-нафтола. В каждую пробирку добавляют по капле раствора хлорида железа (III). В первой пробирке появляется фиолетовое окрашивание, во второй – зеленое, в третьей – фиолетовое, в четвертой – зеленое, переходящее в желтое, в пятой – красное и в шестой – фиолетовое. Фенолы с хлоридом железа (III) образуют различного цвета комплексные соединения, например:
Наблюдение:
Выводы:
Опыт 4.13 Окисление гидрохинона в бензохинон
Реактивы, материалы, приборы: 1%-й раствор хлорида железа (III), 1%-й раствор гидрохинона, 1%-й раствор нитрата серебра, пробирки, мерные пробирки.
а) К 1-2 см3 свежеприготовленного 1%-го раствора гидрохинона прибавляют 2-3 капли 1%-го раствора хлорида железа (III). Раствор окрашивается в желтый цвет вследствие образования бензохинона. б) К 1-2 см3 свежеприготовленного 1%-го раствора гидрохинона прибавляют несколько капель 1%-го раствора нитрата серебра. Выделяется черный осадок металлического серебра.
Наблюдение:
Выводы:
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны являются соединениями с высокой реакционной способностью. Почти все химические свойства связаны с наличием в них сильно поляризованной карбонильной группы С=О. Чем больше положительный заряд на карбонильном углеродном атоме, тем более реакционноспособным является соединение. Активность уменьшается в ряду: формальдегид → альдегид → кетон. Основными химическими реакциями являются: 1. Нуклеофильное присоединение (AN) по карбонильному углеродному атому: HCN образует α-оксинитрилы, NaHSO3 – гидросульфитные производные с альдегидами и метилкетонами; RMgX с альдегидами приводят к образованию вторичных спиртов, с формальдегидом – первичных, с кетонами – третичных спиртов; ROH (Н+) образуют полуацетали и ацетали, NH3 – альдимины и кетимины, RNH2 – основания Шиффа, NH2OH – оксимы, NH2NH2 – гидразоны и азины, NH2NHС6Н5 – фенилгидразоны, NH2NHСONH2 – cемикарбазоны. 2. Нуклеофильное присоединение (AN) по α-углеродному атому (альдольная и кротоновая конденсации). 3. Окисление (реакция серебряного зеркала, реакция Фелинга) приводит к получению карбоновых кислот, восстановление – первичных или вторичных спиртов. Альдегиды, не содержащие при α-углеродном атоме водорода, в присутствии щелочей претерпевают диспропорционирование (реакция Канниццаро). При катализе алкоголятами алюминия альдегиды превращаются в сложные эфиры (реакция Тищенко). 4. Галогенирование по α-углеродному атому. 5. С фуксинсернистой кислотой альдегиды образуют характерное малиновое окрашивание, а с димедоном дают кристалллические осадки. Эти реакции, как и реакции серебряного зеркала и Фелинга, позволяют отличить альдегиды от кетонов.
|
||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.239.65 (0.006 с.) |