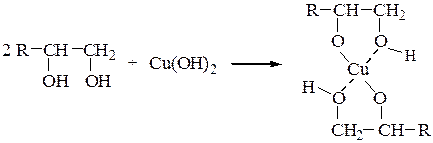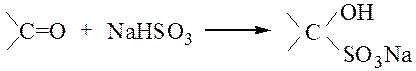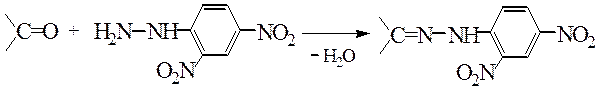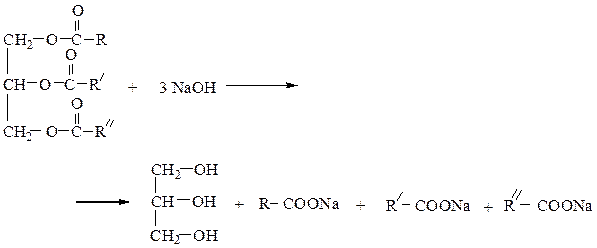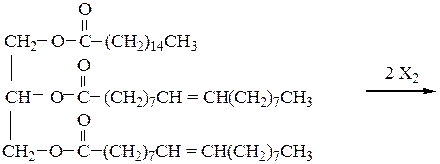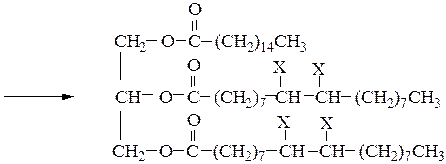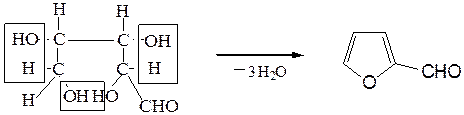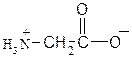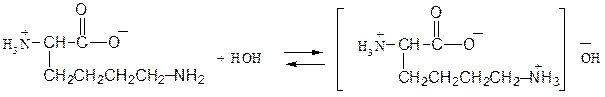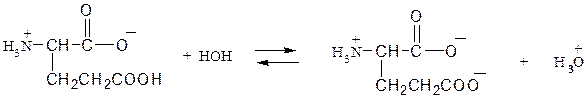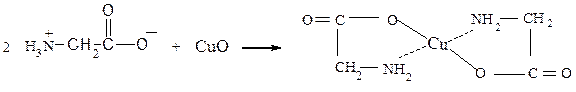Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К лабораторным работам малого практикумаСодержание книги
Поиск на нашем сайте ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПРИКЛАДНОЙ БИОТЕХНОЛОГИИ Кафедра органической химии Органическая химия
РАБОЧАЯ ТЕТРАДЬ К лабораторным работам малого практикума для студентов специальностей 260301, 260302, 260303, 260505, 240502, 261201, 240901, 240902, 111201, 110501, 110500, 080401 и направления подготовки бакалавров 260100 МОСКВА Г. Составители: В.В. КОЛПАКОВА, проф. С.А. ЯНКОВСКИЙ, доц. Г.Х. КУДРЯКОВА, доц. Н.Е. ЕЛИСЕЕВА, к.т.н.
Рабочая тетрадь к малому практикуму по органической химии содержит описания опытов, которые требуют использования небольших количеств реактивов. Опыты знакомят с характерными общими свойствами и реакциями органических соединений различных классов и с индивидуальными особенностями их важнейших представителей. К каждому классу органических соединений приводится теоретический материал и контрольные вопросы. Содержание рабочей тетради дополняет и иллюстрирует материал лекционного курса.
Утверждена УМС МГУПБ.
© МГУПБ, 2009 ВВЕДЕНИЕ
Малый практикум по органической химии является составной частью программы технологических, ветеринарно-санитарных и инженерно-экономических специальностей вузов пищевого профиля. Практикум проводится параллельно лекционному курсу, что способствует более прочному усвоению материала дисциплины. Лабораторные работы практикума знакомят студентов со свойствами различных классов органических соединений и, прежде всего, с качественными реакциями функциональных групп. Опыты рассчитаны на использование малых количеств доступных соединений. При подготовке рабочей тетради использованы материалы методических указаний к лабораторным работам малого практикума по органической химии (МГУПБ, 2009 г), которые в данном руководстве в значительной степени переработаны и дополнены.
КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В состав органических соединений кроме углерода входят водород, кислород, азот, сера, галогены и другие элементы. Ввиду того что элементы, входящие в состав органического соединения, связаны между собой ковалентной связью, обычные методы качественного анализа не применимы для органических соединений. Для обнаружения углерода, водорода, азота, серы, галогенов и других элементов органическое вещество разрушают полным окислением или восстановлением, при этом исследуемые элементы переходят в неорганические соединения, которые и открывают классическими методами аналитической химии.
Опыт 2.1 Открытие углерода и водорода окислением вещества оксидом меди (II) Реактивы, материалы, приборы: глюкоза (или сахароза), оксид меди (II), баритовая или известковая вода, безводный сульфат меди (II), газоотводная трубка с пробкой, пробирки, спиртовки.
При нагревании органического вещества с оксидом меди (II) углерод превращается в оксид углерода (IV), а водород – в воду. Окисление глюкозы происходит по уравнению:
С 6 H12O6 + 12CuO ¾ ® 6CO2 + 6H2O + 12Cu
Ba (OH)2 + CO2 ¾ ® BaCO3↓ + H2O BaCO3 + H2O + CO2 ¾ ® Ba (HCO3)2 CuSO4 + 5 H2O ¾ ® CuSO4 ▪ 5 H2O
Наблюдение:
Выводы:
ОТКРЫТИЕ АЗОТА И СЕРЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Опыт 2.2.1 Открытие азота в мочевине
Реактивы, материалы, приборы: мочевина, натронная известь, красная лакмусоваябумага, пробирки, спиртовки.
В пробирке смешивают несколько кристаллов мочевины и натронной извести. Смесь в пробирке осторожно нагревают. К отверстию пробирки подносят влажную красную лакмусовую бумагу. Мочевина разлагается натронной известью с образованием аммиака. Аммиак обнаруживают по запаху и изменению цвета (посинение) лакмусовой бумаги.
Выделение аммиака указывает на наличие азота в исследуемом веществе.
Наблюдение:
Выводы:
Опыт 2.2.4 Открытие азота и серы в шерстяном волокне
Реактивы, материалы, приборы: шерсть, металлический натрий, вода, кристаллический сульфат железа (II), 1-й раствор хлорида железа (III), 10%-й раствор соляной кислоты, 1%-й раствор ацетата свинца, уксусная кислота, 2%-й раствор нитропруссида натрия, тиомочевина, натронная известь, лакмусовая бумага, пробирки, спиртовки, капельницы, фарфоровая чашка, воронка, бумажный фильтр, пипетки.
В сухую пробирку вносят небольшое количество исследуемого вещества (шерсть) и кусочек металлического натрия величиной с горошину (РАБОТАТЬ В ВЫТЯЖНОМ ШКАФУ С ЗАЩИТНЫМ ЭКРАНОМ!). Пробирку в пламени горелки нагревают до температуры красного каления и опускают в фарфоровую чашку с 4-5 см3 воды. Образующийся раствор отфильтровывают от угля и стекла и делят на четыре части. Обнаружение азота методом Лассеня. При сплавлении с натрием органическое вещество (кератин – белок шерсти) разлагается и содержащийся азот образует с углеродом и натрием цианид натрия, который обнаруживают переводом его в берлинскую лазурь. Для этого к одной части фильтрата добавляют 2-3 кристаллика сульфата железа (II), нагревают до кипения, приливают 2-3 капли 1%-го раствора хлорида железа (III) и подкисляют соляной кислотой. При наличии в исследуемом веществе азота появляется синяя окраска берлинской лазури:
Na + [ С ] + [N] ® NaCN FeSO4 + NaOH ® Fe(OH)2 ¯ + Na2SO4 6 NaCN + Fe(OH)2 ¾ ® Na4[Fe(CN)6] + 2 NaOH Na4 [Fe(CN)6] + FeCl3 ¾ ® NaFe [Fe(CN)6] ¯ + 3 NaCl берлинская лазурь
Открытие серы. Врезультате восстановительной деструкции шерсти при сплавлении с металлическим натрием образуется сульфид натрия. Сульфид-анион открывают обычными качественными реакциями: 1. Ко второй пробирке фильтрата (см. выше) добавляют 0,5 см3 1%-го раствора ацетата свинца и подкисляют уксусной кислотой. Присутствие серы обнаруживается по образованию коричнево-черного осадка сульфида свинца:
Na2S + (CH3COO)2 Pb ¾ ® 2 CH3COONa + PbS ↓
2. К третьей пробирке (см. выше) приливают 0,5 см3 2%-го раствора нитропруссида натрия. Появляется интенсивное красно-фиолетовое окрашивание, переходящее постепенно в бурый цвет:
Na2S + Na2 [Fe(CN)5 (N О)] ¾ ® Na4[Fe(CN)5 (N О S)]
3. К четвертой пробирке по каплям прибавляют 10%-й раствор соляной кислоты; при этом появляется характерный запах сероводорода:
Na 2 S + 2 HCl ¾ ® H 2 S + 2 NaCl
Наблюдение:
Выводы:
Опыт 2.2.5 Открытие галогенов
В большинстве органических соединений галоген прочно связан с углеродом ковалентной связью, поэтому его нельзя обнаружить реакцией с нитратом серебра. Для обнаружения галогена органическое вещество либо восстанавливают водородом в момент выделения (натрий в спирте), тогда галоген превращается в анион, либо проводят опыт с получением зеленой окраски пламени.
Реактивы, материалы, приборы: хлороформ, тетрахлорид углерода, нитрат серебра, медная проволока, дистиллированная вода, лакмусовая бумага.
Реакция с нитратом серебра. Полоску фильтровальной бумаги смачивают исследуемым раствором вещества (хлороформом) и сжигают под мокрой химической воронкой. Продукты горения смывают дистиллированной водой в пробирку, добавляют раствор нитрата серебра. Образование осадка галогенида серебра указывает на присутствие галогена в исследуемом веществе.
2 CHCl3 + O2 + 2 H2O ¾ ® 2 CO2 + 6 HCl HCl + AgNO3 ¾ ® AgCl ↓+ HNO3
Проба Ф. Ф. Бейльштейна. Медную проволоку с петлей на конце прокаливают на горелке до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (II), опускают в пробирку с каплей тетрахлорметана и вновь вносят в пламя горелки. Пламя окрашивается в зеленый цвет, что указывает на присутствие в органическом соединении галогена.
CCl 4 + 2 CuO ¾ ® 2 CuCl 2 + CO 2
Медь с галогеном образует соединение, пары которого и окрашивают пламя горелки в зеленый цвет.
Наблюдение:
Выводы:
УГЛЕВОДОРОДЫ
В составе органического вещества углерод находится в одном из трех валентных состояний – Sp3, Sp2 и Sp-гибридизация. В образовании простой, одинарной σ-связи со стороны атома углерода всегда участвует гибридная Sp3, Sp2 и Sp-орбиталь. Для нее характерно перекрывание электронных орбиталей вдоль линии связи, соединяющей центры взаимодействующих атомов. Такая связь прочная, дипольный момент ее незначительный. Кратные π-связи образованы не гибридными, а р-орбиталями за счет их перекрывания по обе стороны линии, соединяющей центры атомов. Электронная плотность π-связи удалена от ядер, перекрывание р-орбиталей меньше, поэтому они менее прочные, полярные и легкоразрывающиеся под внешним воздействием. Отсюда и различие в свойствах насыщенных углеводородов (алканы, циклоалканы) и ненасыщенных (алкены, алкины). Алканы устойчивы к различным реагентам, для них типичны гомолитические, радикальные реакции замещения – SR, идущие в присутствии таких активаторов, как свет, температура, пероксиды. Ненасыщенные углеводороды значительно более реакционноспособные, для них характерен гетеролиз π-связи, следствием чего являются реакции электрофильного присоединения АЕ, реакции окисления и полимеризации, а для алкинов – еще и реакции замещения «кислого» водорода у тройной связи на металл. В данном случае проявляются кислотные свойства ацетилена и моноалкилацетиленов, обусловленные большей электроноотрицательностью атома углерода в состоянии Sp-гибридизации, т.е. большей долей π-электронов, по сравнению с Sp2- и Sp3-гибридизацией, что вызывает сдвиг электронной плотности в молекуле: Нδ+ →Сδ– ≡ Сδ– ← Нδ+ Электронная конфигурация ароматических углеводородов (арены) характеризуется копланарностью атомов цикла и наличием (4n + 2) π-электронов. π-Электронная плотность распределена по всей π-орбитальной системе над и под плоскостью цикла в виде двух тор, образуя как бы единую π-связь. Такая делокализация π-электронов обуславливает необычно низкую энергию невозбужденного состояния аренов, их повышенную термодинамическую стабильность. Несмотря на наличие π-связи, т.е. на ненасыщенный характер ядра аренов, реакции, идущие с разрывом π-связи (реакции присоединения, окисления), не являются для них типичными, хотя и могут происходить в определенных условиях. Характерными реакциями аренов являются реакции электрофильного замещения (SЕ) – галогенирования, нитрования, сульфирования, алкилирования, ацилирования и др. В этих реакциях бензольное ядро служит источником π-электронов, которые удерживаются ядрами углерода слабее и доступны для электрофильных реагентов. В производных бензола группа, связанная с кольцом, влияет на реакционную способность и определяет ориентацию заместителя. Электронодонорные заместители, проявляющие +Мэфф. или +Iэфф. (группы OH, OR, NH, NR2), активируют ядро, облегчая Iэфф, и направляют новый заместитель в орто- и пара-положения. Галогены, хотя и ориентируют благодаря своему +Мэфф. новый заместитель в орто- и пара-положения, но из-за –Iэфф. затрудняют процесс замещения. Электроноакцепторные заместители (NO2 SO3H COOH CN CCl3 и др.) дезактивируют бензольное ядро, затрудняют SЕ и направляют новый заместитель в мета-положение. Различие в действии ориентантов I и II рода является следствием их влияния на стабильность образующихся σ-комплексов.
АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
Опыт 3.1.2 Реакции алканов
Реактивы, материалы, приборы: петролейный эфир с т. кип. 50-70ºС, содержащий смесь пентана и гексана или вазелиновое масло (смесь высококипящих жидких алканов), 5%-й раствор карбоната натрия, 2%-й раствор перманганата калия, серная кислота концентрированная, 5%-й раствор брома в CCl4, 25%-й раствор аммиака, пробирки, стеклянная палочка, индикаторная бумага, пробирки, капельницы.
Отношение алканов к водному раствору перманганата калия. В две пробирки наливают по 1 см3 насыщенных углеводородов, 1 см3 5 %-го раствора соды, затем по каплям при встряхивании добавляют раствор KMnO4. Изменяется ли окраска перманганата калия?
Отношение алканов к концентрированной серной кислоте. В две сухие пробирки наливают по 1 см3 насыщенных углеводородов и 1 см3 концентрированной серной кислоты. Содержимое пробирок взбалтывают в течение 2-3 минут. Происходят ли изменения? Разогревается ли смесь?
Бромирование алканов. (РАБОТУ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ). В сухие пробирки наливают по 1 см3 насыщенных углеводородов и добавляют несколько капель 5 %-го раствора брома в CCl4. Содержимое пробирок встряхивают при комнатной температуре. Изменяется ли окраска брома? Затем смесь нагревают на кипящей водяной бане. Окраска брома постепенно исчезает и выделяется бромоводород. Его обнаруживают по изменению окраски влажной индикаторной бумаги, поднесенной к пробирке, или по образованию тумана NH4Br при внесении в выделяющиеся пары стеклянной палочки, смоченной в 25 %-ном водном растворе аммиака. Напишите уравнение реакции бромирования 3-метилпентана и разберите ее механизм.
Наблюдение:
Выводы:
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ Опыт 4.3 Образование и гидролиз алкоголятов
Реактивы, материалы, приборы: этанол, металлический натрий, фенолфталеин, пробирки, капельницы, пробка с газоотводной трубкой, мерные пробирки.
В сухую пробирку наливают 2 см3 этанола, вносят кусочек (не более размера горошины) очищенного от оксидной пленки металлического натрия. Пробирку закрывают пробкой с газоотводной трубкой, конец которой оттянут. Через 1-2 мин после начала реакции осторожно поджигают выделяющийся водород. После окончания реакции (в пробирке не должно быть натрия!) добавляют 1,5-2 см3 воды и 1-2 капли фенолфталеина. Наблюдают образование малиновой окраски раствора, что доказывает наличие его щелочной среды.
2R–OH + 2Na ¾ ® 2R–ONa + H2 ↑ R–ONa + H2O ¾ ® R–OH + NaOH
Наблюдение:
Выводы:
Опыт 4.4 Реакция многоатомных спиртов с
Реактивы, материалы, приборы: этанол, этиленгликоль, глицерин, маннит, 1%-й раствор сульфата меди, 10%-й раствор гидроксида натрия, пробирки, мерные пробирки.
Гидроксид меди (II) получают смешиванием 3 см3 1%-го раствора сульфата меди с 3 см3 10%-го раствора гидроксида натрия. Он образуется в виде студенистого светло-голубого осадка. Его разливают в четыре пробирки. В первую пробирку добавляют 1 см3 этанола. Растворения и изменения окраски гидроксида меди (II) не происходит. Во вторую и в третью пробирки добавляют по 1 см3 этиленгликоля и глицерина, а в четвертую – 0,5 г кристаллического маннита. Многоатомные спиртырастворяют свежеприготовленный осадок Cu(OH)2 c образованием темно-синих растворов комплексных соединений меди (II) хелатного типа:
Наблюдение:
Выводы:
Опыт 4.6 Образование йодоформа из этанола
Реактивы, материалы, приборы: этанол, 2%-й раствор йода, 1%-й раствор йодида калия, уксусная кислота, 5%-й раствор гидроксида натрия, пробирки, капельницы, спиртовки.
В пробирке к 2 см3 воды добавляют 3-4 капли этилового спирта, нагревают до 60ºС и приливают 1 см3 2%-го раствора йода, а затем 5%-го раствора гидроксида натрия по каплям до обесцвечивания. Образующийся йодоформ выпадает сразу в виде мелкого светло-желтого осадка с характерным запахом. Реакция протекает в три стадии:
С H3CH2OH + NaOI ¾ ® С H3CHO + NaI + H2O С H3CHO + 3I2 + 3NaOH ¾ ® 3 NaI + С I3CHO + 3H2O С I3CHO + NaOH ¾ ® С HI3 ↓ + HCOONa
Наблюдение:
Выводы:
Опыт 4.9 Образование и разложение фенолятов
Реактивы, материалы, приборы: фенол, β-нафтол, 2 н раствор гидроксида натрия, 2 н раствор карбоната натрия, 2 н раствор серной кислоты, пробирки, мерные пробирки.
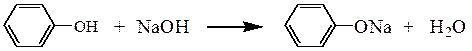
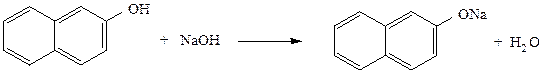
В две пробирки вносят по 0,1-0,2 г фенола, а в третью пробирку – 0,1-0,2 г β-нафтола, добавляют по 2 см3 воды и наблюдают отсутствие растворения соединений. В первую и третью пробирки прибавляют 1-2 см3 2 н раствора гидроксида натрия, а во вторую пробирку 2 см3 2 н раствора карбоната натрия. Постепенно происходит растворение фенолов с образованием фенолята и β-нафтолята натрия. При подкислении полученных растворов 2 н. раствором серной кислоты наблюдается помутнение растворов с выделением свободных фенола и β-нафтола, труднорастворимых в воде.
Наблюдение:
Выводы:
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны являются соединениями с высокой реакционной способностью. Почти все химические свойства связаны с наличием в них сильно поляризованной карбонильной группы С=О. Чем больше положительный заряд на карбонильном углеродном атоме, тем более реакционноспособным является соединение. Активность уменьшается в ряду: формальдегид → альдегид → кетон. Основными химическими реакциями являются: 1. Нуклеофильное присоединение (AN) по карбонильному углеродному атому: HCN образует α-оксинитрилы, NaHSO3 – гидросульфитные производные с альдегидами и метилкетонами; RMgX с альдегидами приводят к образованию вторичных спиртов, с формальдегидом – первичных, с кетонами – третичных спиртов; ROH (Н+) образуют полуацетали и ацетали, NH3 – альдимины и кетимины, RNH2 – основания Шиффа, NH2OH – оксимы, NH2NH2 – гидразоны и азины, NH2NHС6Н5 – фенилгидразоны, NH2NHСONH2 – cемикарбазоны. 2. Нуклеофильное присоединение (AN) по α-углеродному атому (альдольная и кротоновая конденсации). 3. Окисление (реакция серебряного зеркала, реакция Фелинга) приводит к получению карбоновых кислот, восстановление – первичных или вторичных спиртов. Альдегиды, не содержащие при α-углеродном атоме водорода, в присутствии щелочей претерпевают диспропорционирование (реакция Канниццаро). При катализе алкоголятами алюминия альдегиды превращаются в сложные эфиры (реакция Тищенко). 4. Галогенирование по α-углеродному атому. 5. С фуксинсернистой кислотой альдегиды образуют характерное малиновое окрашивание, а с димедоном дают кристалллические осадки. Эти реакции, как и реакции серебряного зеркала и Фелинга, позволяют отличить альдегиды от кетонов.
Опыт 5.4 Образование гидросульфитных производных
Реактивы, материалы, приборы: формалин, ацетон, гидросульфит натри, 10%-й раствор соляной кислоты, пробирки, мерные пробирки, микроскоп.
В две пробирки наливают по 1 см3 насыщенного раствора гидросульфита натрия и добавляют в одну из них равный объем формалина, а в другую – ацетона. Пробирки встряхивают 1-2 мин. Через некоторое время наблюдается выпадение кристаллов гидросульфитного производного соединения, которые хорошо видны под микроскопом:
При добавлении в пробирки с кристаллами по 1 см3 10%-й HCl гидросульфитные соединения разрушаются с регенерацией формальдегида и ацетона.
Наблюдение:
Выводы:
Опыт 5.5 Получение фенилгидразонов карбонильных
Реактивы, материалы, приборы: 40%-й раствор формальдегида, уксусный альдегид, солянокислый раствор 2,4-динитрофенил-гидразина, пробирки, капельницы.
В три пробирки наливают по 10 капель солянокислого раствора 2,4-динитрофенилгидразина и добавляют по 2 капли: в первую – формалина, во вторую – уксусного альдегида, в третью – ацетона. Наблюдают выпадение желтых осадков 2,4-динитрофенилгидразонов.
Наблюдение:
Выводы:
Опыт 5.6 Реакции карбонильных соединений
Реактивы, материалы, приборы: ацетон, 2%-й раствор солянокис-лого гидроксиламина, 2%-й раствор метилоранжа, капельницы, пробирки.
В две пробирки помещают по 5 капель раствора солянокислого гидроксиламина, 1-2 капли метилоранжа, затем в одну из пробирок добавляют 2-3 капли ацетона. Сравнивают окраску растворов в пробирках. Соединения, содержащие карбонильную группу, при взаимодействии с солянокислым гидроксиламином выделяют свободную соляную кислоту, присутствие которой можно обнаружить по изменению окраски индикатора.
Оксим
Наблюдение:
Выводы:
Br Br
в) Окисление олеиновой кислоты водным раствором перманганата калия. В пробирку помещают 1 см3 5%-го раствора перманганата калия, 1 см3 10%-го раствора карбоната натрия и 0,5 см3 олеиновой кислоты. Смесь энергично перемешивают. Отмечают обесцвечивание реакционной смеси.
К MnO 4 СН3(СН2)7СН=СН(СН2)7СООН ¾ ® СН3(СН2)7–СН–СН–(СН2)7СООН │ │ OH OH Что образуется при окислении олеиновой кислоты концентрированным раствором перманганата калия при нагревании в присутствии H2SO4?
Наблюдение:
Выводы:
ЖИРЫ И МАСЛА Опыт 6.2.1 Омыление жира
Реактивы, материалы, приборы: животный жир, 40%-й раствор гидроксида натрия, насыщенный раствор хлорида натрия, фарфоровые чашки, стеклянные палочки, мерные пробирки, штативы.
Напишите уравнение реакции гидролиза тристеарата глицерина в кислой среде и с помощью раствора гидроксида натрия.
РАБОТУ ПРОВОДЯТ ЗА ЗАЩИТНЫМ ЭКРАНОМ ИЛИ В ОЧКАХ! В фарфоровую чашку помещают 2-3 г животного жира, добавляют 7 см3 40%-го раствора гидроксида натрия и смесь кипятят при слабом нагревании при помешивании стеклянной палочкой. По мере выкипания добавляют воду. Через 15 мин прибавляют 7 см3 насыщенного раствора хлорида натрия, массу охлаждают, выпавшее мыло отфильтровывают. Мыльную воду и мыло используют для дальнейших реакций.
Наблюдение:
Выводы:
Опыт 6.2.4 Образование кальциевых солей жирных кислот
Реактивы, материалы, приборы: мыло, 5%-й раствор хлорида кальция, пробирки.
В воде растворяют небольшой кусочек полученного мыла и добавляют 1 см3 5%-го раствора хлорида кальция. При нагревании выпадает осадок кальциевых солей высших карбоновых кислот.
2R–COONa + Са Cl2 ¾¾ ® (R–COO)2 Са ↓ + 2NaCl
Аналогично в процессе обменных реакций осаждаются нерастворимые в воде соли свинца и меди с анионами высших карбоновых кислот.
Напишите уравнение реакции пальмитата натрия с нитратом кальция.
Наблюдение:
Выводы:
Опыт 6.2.5 Обнаружение остатков ненасыщенных
Реактивы, материалы, приборы: подсолнечное масло, маргарин, хлороформ, 1%-й водный раствор крахмала, 0,05%-й раствор йода в спирте, пробирки, капельницы.
В две пробирки наливают по 1 см3 хлороформа и добавляют в одну из них 0,5 г маргарина, а в другую 0,5 г подсолнечного масла. Встряхивают до полного растворения, добавляют по 2 капли 1%-го водного раствора крахмала и приливают 0,05%-ный спиртовой раствор йода до появления синего окрашивания. На поверхности смеси появляется синее кольцо. Присоединение йода (Х=I) происходит по двойным связям, которые содержатся в остатках ненасыщенных жирных кислот подсолнечного масла (олеиновая, линолевая, линоленовая): 1-Пальмитоил - 2,3 - диолеилглицерин
Реакция присоединения йода по месту разрыва двойных связей в жирных кислотах является качественной пробой на свойство непредельности жира. При количественном определении степени ненасыщенности жира определяют йодное число, т.е. количество граммов йода, присоединяющееся к 100 г жира. Рассчитайте йодное число триолеата глицерина.
Наблюдение:
Выводы:
УГЛЕВОДЫ Сахариды – это циклические полуацетали алифатических многоатомных гидроксиальдегидов или гидроксикетонов. В растворе циклические полуацетали находятся в таутомерном равновесии с открытыми цепными формами, содержащими свободные карбонильные группы. Поэтому для сахаридов характерны реакции как по карбонильной группе (окисление, восстановление, присоединение синильной кислоты, образование оксимов, озазонов), так и по спиртовым и гликозидному гидроксилам в циклической форме с образованием сахаратов, простых, сложных эфиров и гликозидов. МОНОСАХАРИДЫ ДИСАХАРИДЫ
Опыт 7.2.4 Образование фурфурола из пентозанов
Реактивы, материалы, приборы: анилин, уксусная кислота ледяная, соляная кислота (ρ=1,19 г/см3), 0,1 н раствор хлорида железа (III), древесные опилки, пробирки, капельницы, стеклянные палочки, пробки с газоотводной трубкой, спиртовки, фильтровальная бумага.
В древесных опилках, соломе, сене, вишневом клее, отрубях, в подсолнечной шелухе содержатся полисахариды пентозаны. Под действием ферментов или при нагревании с минеральными кислотами они подвергаются гидролизу с образованием пентоз. Фурфурол, образующийся из пентоз, обнаруживается по реакции с солями анилина. (С5Н8О4) n + х Н2О ¾ ® х С5Н10О5 пентозаны альдопентоза
альдопентоза фурфурол
В пробирку помещают щепотку древесных опилок, 5 капель соляной кислоты и 2 капли раствора хлорида железа (III). Содержимое пробирки перемешивают стеклянной палочкой и осторожно нагревают 1-2 мин в пламени горелки. После этого отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опускают в пробирку-приемник, охлаждаемую ледяной водой, и продолжают нагревать содержимое реакционной пробирки, отгоняя фурфурол. На полоску фильтровальной бумаги помещают каплю отгона, каплю анилина и каплю ледяной уксусной кислоты. На бумаге образуется розово-красное пятно.
Наблюдение:
Выводы:
ПОЛИСАХАРИДЫ
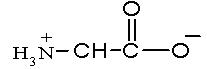
АМИНОКИСЛОТЫ И БЕЛКИ Аминокислоты, имея в своем составе кислую карбоксильную и основную аминогруппы, проявляют амфотерные свойства. Они способны реагировать со щелочами и кислотами с образованием солей и реагировать по амино- (как амины) и по карбоксильной группе с образованием функциональных производных карбоновых кислот. Аминокислоты существуют в виде биполярных ионов (внутренние соли):
│ R В зависимости от количества в молекуле аминокислот амино- и карбоксильных групп они делятся на нейтральные, кислые и основные. Принадлежность к той или иной группе определяется по показаниям индикаторов для их водных растворов. Пептиды и белки состоят из остатков α,L-аминокислот, связанных пептидными (амидными) связями. Полипептиды с относительной молекулярной массой более 6000 Да (дальтон) принято считать белками. Структура белка рассматривается на нескольких уровнях. Разупорядочение пространственной структуры белка под действием физических и химических факторов (нагревание, облучение, действие кислот, солей тяжелых металлов и т.д.) представляет собой явление денатурации. АМИНОКИСЛОТЫ
Опыт 8.1.1 Определение рН водных растворов
Реактивы, материалы, приборы: 1%-ные водные растворы глицина, лизина, глутаминовой кислоты, универсальная индикаторная бумага, капельницы.
На универсальную индикаторную бумагу наносят по 1 капле 1%-ных водных растворов глицина, глутаминовой кислоты и лизина. Что наблюдается? Определите рН растворов исследуемых аминокислот.
Наблюдение:
Выводы:
Опыт 8.1.2 Образование комплексной медной
Реактивы, материалы, приборы: глицин, оксид меди, пробирки, спиртовки, баня с ледяной водой.
Растворяют 0,5 г глицина в 2 см3 воды, прибавляют немного порошкообразного оксида меди (II) и смесь нагревают до кипения. Раствор окрашивается в синий цвет. Пробирку охлаждают в бане с ледяной водой. Наблюдают выпадение синих кристаллов труднорастворимой комплексной медной соли глицина. Кристаллы рассматривают в микроскопе.
Наблюдение:
Выводы:
ПЕПТИДЫ И БЕЛКИ Опыт 8.2.6 Реакция Милона
Реактивы, материалы, приборы: 10%-й раствор белка, реактив Милона (раствор ртути в азотной кислоте, содержащей азотистую кислоту), пробирки, спиртовки.
К 2 см3 раствора белка добавляют равный объем реактива Милона, встряхивают и осторожно нагревают. Выпадает кораллово-красный осадок комплексного фенолята ртути аминокислоты тирозина. Напишите два пентапептида: H – Val – Tyr – Met – Gly – Ala – OH и H – Ser – Asp – Gly – Lys – Val – OH и укажите, какие качественные реакции дает каждый из них.
Наблюдение:
Выводы:
БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Белобородов В.Л. Органическая химия: учебник / В.Л. Белобородов, С.Э. Зурабян, А.П. Лузин / под ред. Н.А. Тюкавкиной. – М.: Дрофа, 2002. – Кн.: Основной курс. – 640 с. 2. Грандберг И.И. Органическая химия: учебник / И.И. Грандберг. - М.: Дрофа, 2000. – 672 с. 3. Ким А.М. Органическая химия: учебник / А.М. Ким. – Новосибирск: Сибирское университетское изд-во, 2001. – 814 с. 4. Колпакова В.В. Лабораторные работы малого практикума. Методические указания к лабораторным работам для студентов специальностей. 260301, 260302, 260303, 260505, 240502, 261201, 240901, 240902, 111201, 110501, 110500, 080401 и направления подготовки бакалавров 260100 / В.В. Колпакова, С.А. Янковский, Г.Х Кудрякова. – М.: МГУПБ, 2009. – 54 с. 5. Нейланд О.Я. Органическая химия: учебник / О.Я. Нейланд. - М.: Высшая школа,1990. 6. Петров А.А. Органическая химия: учебник / А.А. Петров, Х.В. Бальян, А.Т. Трощенко. – СПб.: Иван Федоров, 2002. – 622 с. 7. Сайкс П. Механизмы органических реакций: учебник / П. Сайкс. - М.: Химия, 1991. – 280 с. 8. Травень В.Ф. Органическая химия: учебник / В.Ф. Травень. – М.: Академкнига, 2004. – Т. 1. – 727 с. 9. Травень В.Ф. Органическая химия: учебник / В.Ф. Травень. – М.: Академкнига, 2004. – Т. 2. – 582 с. 10. Тюкавкина Н.А. Биоорганическая химия: учебник / Н.А. Тюкавкина, Ю.И. Бауков. - М.: Медицина, 1991. - с. 527. 11. Шабаров Ю.С. Органическая химия: учебник / Ю.С. Шабаров. – М.: Химия, 2000. – 848 с. 12. Янковский С.А. Словарь терминов и определений по органической химии: учебное пособие / С.А. Янковский, Г.Х. Кудрякова, В.А. Панкратов. – М.: МГУПБ, 2009. – 214 с.
CОДЕРЖАНИЕ С.
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 401; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.018 с.) |

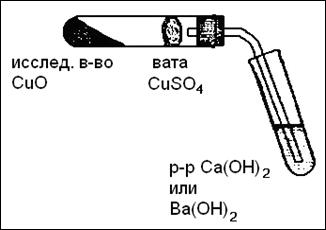 В сухую пробирку вносят смесь исследуемого вещества с оксидом меди (II). В верхнюю часть пробирки помещают маленький кусочек ваты, на который насыпают немного безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой, конец которой опущен в пробирку с баритовой (известковой) водой. Пробирку закрепляют горизонтально и нагревают на пламени горелки. Баритовая вода мутнеет, вследствие выделения осадка карбоната бария, что указывает на присутствие углерода в исходном веществе. При дальнейшем пропускании СО2 происходит переход нерастворимого в воде карбоната бария в растворимый гидрокарбонат. Пары воды, пройдя через ватный тампон, присоединяются к безводному сульфату меди и образуют кристаллогидрат сульфата меди синего цвета (медный купорос), что свидетельствует о присутствии водорода в глюкозе.
В сухую пробирку вносят смесь исследуемого вещества с оксидом меди (II). В верхнюю часть пробирки помещают маленький кусочек ваты, на который насыпают немного безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой, конец которой опущен в пробирку с баритовой (известковой) водой. Пробирку закрепляют горизонтально и нагревают на пламени горелки. Баритовая вода мутнеет, вследствие выделения осадка карбоната бария, что указывает на присутствие углерода в исходном веществе. При дальнейшем пропускании СО2 происходит переход нерастворимого в воде карбоната бария в растворимый гидрокарбонат. Пары воды, пройдя через ватный тампон, присоединяются к безводному сульфату меди и образуют кристаллогидрат сульфата меди синего цвета (медный купорос), что свидетельствует о присутствии водорода в глюкозе.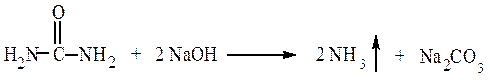
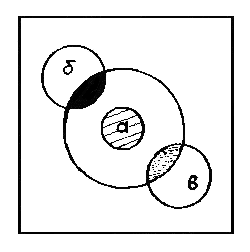 Микроколичества азота и серы в органических соединениях можно обнаружить по методу Рево. Для этого отфильтрованный раствор набирают в пипетку и наносят на фильтровальную бумагу размером 3 х 3 см в виде пятна диаметром в центре 2 см. В центре пятна наносят 1 каплю 0,1 н раствора сульфата железа (II). Когда жидкость впитается, туда же наносят 1 каплю 2 н раствора соляной кислоты. При наличии азота сразу же появляется синее пятно берлинской лазури (а). По периферии пятна исследуемого вещества наносят 1 каплю 0,1 н раствора ацетата свинца, а в противоположную сторону пятна – 1 каплю 0,5 н раствора нитропруссида натрия. При наличии серы в исследуемом веществе в первом случае (б) появится темно-коричневое пятно сульфида свинца, а в противоположной стороне (случай в) – красно-фиолетовое пятно комплексной соли Na4 [Fe(CN)5 (NОS)].
Микроколичества азота и серы в органических соединениях можно обнаружить по методу Рево. Для этого отфильтрованный раствор набирают в пипетку и наносят на фильтровальную бумагу размером 3 х 3 см в виде пятна диаметром в центре 2 см. В центре пятна наносят 1 каплю 0,1 н раствора сульфата железа (II). Когда жидкость впитается, туда же наносят 1 каплю 2 н раствора соляной кислоты. При наличии азота сразу же появляется синее пятно берлинской лазури (а). По периферии пятна исследуемого вещества наносят 1 каплю 0,1 н раствора ацетата свинца, а в противоположную сторону пятна – 1 каплю 0,5 н раствора нитропруссида натрия. При наличии серы в исследуемом веществе в первом случае (б) появится темно-коричневое пятно сульфида свинца, а в противоположной стороне (случай в) – красно-фиолетовое пятно комплексной соли Na4 [Fe(CN)5 (NОS)].