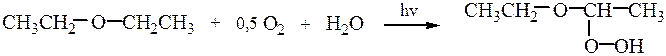Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4.5 Получение и свойства диэтилового эфира
Реактивы, материалы, приборы: этанол, серная кислота концентрированная, 1%-й раствор йодида калия, уксусная кислота, пробирки, спиртовки, капельницы, мерные пробирки.
а) Получение диэтилового эфира. Смешивают в пробирке 1 см3 этилового спирта с 1 см3 концентрированной серной кислоты. Разогревшуюся смесь осторожно нагревают до кипения и, прекратив обогрев, добавляют еще 5-6 капель этилового спирта. Образующийся при этом диэтиловый эфир легко обнаруживается по характерному запаху.
С H3CH2OH + HOSO3H ¾ ® С H3CH2OSO3H + H2O С H3CH2OSO3H + HOCH2CH3 ¾ ® С H3CH2–O–CH2CH3 + H2O
б) Обнаружение пероксидов в диэтиловом эфире. Диэтиловый эфир при хранении и соприкосновении с воздухом (особенно на свету) окисляется с образованием взрывоопасных гидропероксидов:
Наличие пероксидов в эфире устанавливается по выделению йода из подкисленного раствора йодида калия:
ROOH + KI + 2H+ ¾ ® I2 + ROH + H2O + 2K+
К 1 см3 эфира добавляют 1 см3 1%-го раствора йодида калия, 2-3 капли уксусной кислоты и осторожно встряхивают. При наличии пероксидов через 1-2 мин эфирный слой окрашивается йодом в характерный цвет.
Наблюдение:
Выводы:
Опыт 4.6 Образование йодоформа из этанола
Реактивы, материалы, приборы: этанол, 2%-й раствор йода, 1%-й раствор йодида калия, уксусная кислота, 5%-й раствор гидроксида натрия, пробирки, капельницы, спиртовки.
В пробирке к 2 см3 воды добавляют 3-4 капли этилового спирта, нагревают до 60ºС и приливают 1 см3 2%-го раствора йода, а затем 5%-го раствора гидроксида натрия по каплям до обесцвечивания. Образующийся йодоформ выпадает сразу в виде мелкого светло-желтого осадка с характерным запахом. Реакция протекает в три стадии:
С H3CH2OH + NaOI ¾ ® С H3CHO + NaI + H2O С H3CHO + 3I2 + 3NaOH ¾ ® 3 NaI + С I3CHO + 3H2O С I3CHO + NaOH ¾ ® С HI3 ↓ + HCOONa
Наблюдение:
Выводы:
Опыт 4.7 Окисление спиртов хромовой смесью
Реактивы, материалы, приборы: хромовая смесь, этанол, изоамиловый спирт, третбутиловый спирт, пробирки.
В две пробирки наливают по 2-3 см3 хромовой смеси и по каплям при встряхивании добавляют в одну пробирку 0,5 см3 этанола (ОСТОРОЖНО! СМЕСЬ СИЛЬНО РАЗОГРЕВАЕТСЯ!), а во вторую – 0,5 см3 изоамилового спирта. Цвет растворов меняется из оранжевого в зеленый.
В пробирке с этиловым спиртом ощущается запах уксусного альдегида, напоминающий запах яблок (НЮХАТЬ ОСТОРОЖНО!), во второй – специфический запах изовалерианового альдегида.
3R–CH2OH + K2Cr2O7 + 4H2SO4 ® 3R–CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Аналогично протекает окисление вторичных спиртов, но образуются кетоны; третичные спирты – не окисляются (оранжевая окраска хромовой смеси не изменяется).
Наблюдение:
Выводы:
Опыт 4.8 Проба Лукаса на первичные, вторичные,
Реактивы, материалы, приборы: раствор хлорида цинка вконцентрированной соляной кислоте, этиловый, изопропиловый и третичный бутиловый спирты, капельницы, пробирки, стаканы, водяная баня.
В три пробирки помещают по 3-4 капли раствора хлорида цинка в соляной кислоте и приливают в одну пробирку 3-4 капли этилового спирта, во вторую – изопропилового, а в третью – третбутилового спирта. Пробирки энергично встряхивают и оставляют в стакане с водой при температуре 25-30ºС. Отмечают, что раствор ZnCl2 в концентрированной HCl через 1-2 мин образует тяжелый маслянистый слой нерастворимого в воде алкилгалогенида для третичного спирта, вызывает помутнение раствора в случае вторичного спирта и остается прозрачным у первичного спирта.
(С H3)2CH–OH + HCl ¾ ® (CH3)2CH–Cl + H2O (С H3)3C–OH + HCl ¾ ® (CH3)3C–Cl + H2O
Без хлорида цинка с соляной кислотой медленно реагирует только третичный спирт, остальные спирты в реакцию не вступают.
Наблюдение:
Выводы:
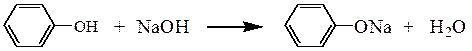
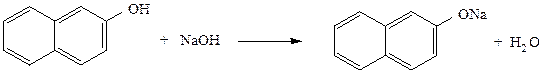
Опыт 4.9 Образование и разложение фенолятов
Реактивы, материалы, приборы: фенол, β-нафтол, 2 н раствор гидроксида натрия, 2 н раствор карбоната натрия, 2 н раствор серной кислоты, пробирки, мерные пробирки.
В две пробирки вносят по 0,1-0,2 г фенола, а в третью пробирку – 0,1-0,2 г β-нафтола, добавляют по 2 см3 воды и наблюдают отсутствие растворения соединений. В первую и третью пробирки прибавляют 1-2 см3 2 н раствора гидроксида натрия, а во вторую пробирку 2 см3 2 н раствора карбоната натрия. Постепенно происходит растворение фенолов с образованием фенолята и β-нафтолята натрия. При подкислении полученных растворов 2 н. раствором серной кислоты наблюдается помутнение растворов с выделением свободных фенола и β-нафтола, труднорастворимых в воде.
Наблюдение:
Выводы:
|
||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 980; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.182.179 (0.012 с.) |