
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Укажите номера реакций, которые не протекаютСодержание книги
Поиск на нашем сайте
Решение. На первом этапе решения задачи учтём результаты диссоциации указанных соединений и запишем составы исходных растворов: · 1) K+ + Cl– + Na+ + NO3– · 2) Na+ + OH– + H+ NO3– · 3) Ca2+ + 2×Cl– + Na+ + OH– + 2×Na+ + CO32– · 4) H+ + Cl– + Na+ + HCO3– · 5) H+ +Cl– + 2×Na+ + SO42– В каждом случае рассмотрим теперь возможность образования малорастворимых соединений (используя таблицы растворимости), выделения газа или образования слабого электролита. В первом случае обменное взаимодействие между ионами не приводит к образованию новых веществ, поскольку KNO3 и NaCl – сильные электролиты. Аналогично поведение ионов в растворе 5): здесь также NaCl и H2SO4 - сильные электролиты. Итак, реакции 1) и 5) не протекают. Для раствора 2) возможно образование слабодиссоциирующего соединения – воды. Запишем сокращённый ионный вид этой реакции H+ + OH– = H2O Такого рода реакции называются реакциями нейтрализации. Аналогично взаимодействие в растворе 4) приводит к образованию слабой угольной кислоты или выделению углекислого газа: H+ + HCO3– = H2CO3 Þ H2O + CO2 Для третьего раствора возможно образование сразу двух малорастворимых соединений: Ca(OH)2 (портландит) и CaCO3 (кальцит): Ca2+ + 2OH– = Ca(OH)2¯ Ca2+ + CO32– = CaCO3¯ Протекание первой или второй реакции зависит от условий проведения опыта. 1.6 Упражнения для самостоятельной работы
1). Укажите недостающие компоненты реакции: x↓ y↓ x↓ y↓ z↓ 1) Fe → Fe2O3 → Fe2(SO4)3 Fe2(SO4)3 → Fe(OH)3 → FeOH(NO3)2 → Fe(NO)3 x↓ y↓ z↓ x↓ y↓ 2) S → SO2 → SO3 → H2SO4 H2SO4 → K2SO4 → BaSO4 x↓ y↓ z↓ k↓ 3) Cu(NO3)2 → CuOHNO3 → Cu(OH)2 → CuO → CuSO4 x↓ y↓ x↓ y↓ z↓ 4) P → P2O5 → H3PO4 H3PO4 → NaH2PO4 → Na2HPO4 → Na3PO4 x↓ y↓ z↓ k↓ 5) Ca → CaO → Ca(OH)2 → CaCO3 → Ca(HCO3)2 x↓ y↓ z↓ k↓ 6) Al → Al2(SO4)3 → Al(OH)3 → Al(OH)2Cl → AlCl3 2)Классифицируйте и назовите соли: Na2SiO3, KHS, Cu(NO3)2; (ZnOH)2S; Pb(HSO4)2; BaI2; [Al(OH)2]2SO3; Fe(H2PO4)2, CaMg(CO3)2, Na6Mg(SO4)4. 3) С какими из следующих веществ может реагировать оксид азота (Ш)? А) СаCl2; Б) H2O; В) H2SO4; Г) KOH 4) С какими из следующих веществ может реагировать оксид серы (IV)? А) NaCl; Б) Na2O; В) HNO3; Г) Ca(OH)2 5) Указать реакции нейтрализации. А) NaCl + AgNO3: Б) Fe(OH)3 + H2SO4; В) NaOH + HNO3; Г) BaCl2 + H2SO4 6) С какими металлами может реагировать раствор хлорида меди (II)? А) Zn; Б) Hg; В) Fe; Г) Ag. 7) С какими металлами может реагировать раствор нитрата свинца(II)? А) Hg, Б) Zn, В) Au, Г) Fe 8) С какими металлами может реагировать соляная кислота? А) Mg, Б) Cu, В) Pt, Г) Ag 9) Какой газ выделяется при взаимодействии разбавленной серной кислоты с железом? А) H2S, Б) H2, В) SO2 10) Какие реакции являются необратимыми? А) Na2SO4 + KCl; Б) K2SO4 + BaCl2, В) Na2SO4 + NH4Cl, Г) NaCl + KBr 11) Какой из указанных оксидов образует кислоту типа Н2ЭО3? А) CO2, Б) Na2O3, В) SO3, Г) P2O5, D) I2O5 12) Какой из указанных оксидов образует кислоту типа Н3ЭО4? А) As2O5, Б) Na2O3, В) SO3, Г) Cl2O5, D) NO2 13) Какие вещества образуются при взаимодействии Al(OH)3 и NaOH: А) Na2O, Б) Al2O3, В) NaAlO2, Г) H2O II. Растворы 2.1 Основные определения и понятия химии растворов Раствором называется однородная (гомогенная) система переменного состава. Под растворимостью понимают массу вещества, способной при данной температуре раствориться в 100 г растворителя. В зависимости от агрегатного состояния растворителя различают газофазные, жидкие и твердые растворы. В термодинамике различают растворы по степени межмолекулярного взаимодействия компонентов раствора. Термодинамическая классификация растворов: идеальные, разбавленные и реальные. В гидрогеохимии растворы различают по степени минерализации раствора. Минерализация раствора m(г/кг) - это суммарное масса растворенных веществ (в граммах) в одном килограмме воды. Установлена следующая классификация вод, см. таблицу:
Пресные воды и частично солоноватые можно отнести к разбавленным растворам, соленые воды - к реальным растворам. Природные растворы образуются в результате растворения в воде компонентов земной коры и газов. В гидрогеохимии для записи качественного и количественного состава раствора пользуются формулой Курлова (в виде дроби) В числители дроби указываются анионы, в знаменатели – катионы, входящие в состав раствора. Количественное содержание ионов дается в процентах от общего количества эквивалентов катионов и анионов. Грамм - эквивалент иона рассчитывается как отношение молярной массы иона к его заряду, эквивалент равен отношению массы иона к г - экв. В формуле Курлова перед дробью записывается общая минерализация природного раствора в промилле. (промилле растворенного вещества – количество растворенного вещества в граммах на 1 кг воды). Задача. Записать формулу Курлова для морской воды состава (в г/1кг воды)
Вычисляем г-экв катионов и анионов, количество их эквивалентов (экв = г/г-экв) и процентное содержание эквивалентов.
Рассчитаем общую минерализацию морской воды в г/кг Н2О: m = 12,86 + 22,26 = 35,12. Запишем формулу Курлова: Хлорид натрия NaCl придаёт воде соленый вкус, сульфат магния MgSO4- горький вкус.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 119; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

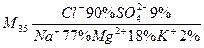 .
.


