
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Имени Серго Орджоникидзе» (МГРИ-РГГРУ)Содержание книги
Поиск на нашем сайте
ФГБОУ ВПО «РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ ГЕОЛОГОРАЗВЕДОЧНЫЙ УНИВЕРСИТЕТ Имени Серго Орджоникидзе» (МГРИ-РГГРУ) К.Б. БИЦОЕВ В.А. УМРИХИН ОБЩАЯ ХИМИЯ Учебное пособие Допущено УМО по образованию в области прикладной геологии в качестве учебного пособия для студентов ВУЗов, обучающихся по специальностям направлений подготовки 130101 «Прикладная геология» И 130102 «Технология геологической разведки» Москва 2014
Рецензент: доктор химических наук, проф. Н.Н. Акинфиев
Бицоев К.Б. Умрихин В.А. Общая химия: учебное пособие
Цель данного пособия – подготовить студентов РГГРУ всех специальностей к прохождению курса физической химии, который будет изучаться ими в течение второго и третьего семестров. В пособии весьма сжато излагаются основные понятия, представления и законы, необходимые для дальнейшего углубленного изучения химии и связанных с ней профильных дисциплин: геохимии, гидрогеологии, экологии, петрографии и др. В пособие включены следующие разделы химии: 1. Атомно-молекулярное учение. 2. Классы неорганических соединений. 3. Растворы. 4. Процессы в растворах. 5. Общие свойства растворов. 6. Окислительно-восстановительные реакции. 7. Дисперсные системы. Коллоиды. 8. Количественные расчеты в химии.
Оглавление Введение. Предмет химии. Основные понятия 5 I. Классификация неорганических соединении 7 I.1. Оксиды. Основные понятия и определения 7 1.1.1. Оснόвные оксиды 1.1.2. Кислотные оксиды 1.1.3. Амфотерные оксиды I.2 Основания 8 I.3 Кислоты. Основные понятия и определения 9 1.3.1. Химические свойства азотной кислоты 1.3.2. Химические свойства серной кислот 1.3.3. Химические свойства сероводородной кислоты I.4 Соли. Основные понятия и определения 10 1.4.1. Химические свойства солей 1.4.2. Двойные и комплексные соли I.5. Решение типовых задач 12
I.6. Упражнения для самостоятельной работы по теме: «Классификация неорганических соединений» II. Растворы 2.1. Основные понятия и определения. Классификация растворов 15 Способы выражения состава раствора 16 Концентрация компонента в растворе 2.2.1. Массовая доля растворенного вещества [δ]. 2.2.2. Процентное содержание вещества в растворе [ω%] 2.2.3. Мольная доля растворенного вещества [χ] 2.2.4. Молярная концентрация растворенного вещества [С(моль/л)] 2.2.5. Моляльная концентрация растворенного вещества [Сm(моль/(кг Н2О))] 2.2.6. Нормальная концентрация растворенного вещества [Н(моль/л)] a) Эквивалент растворенного вещества б) Решение задач с использованием закона эквивалентов в) Закон эквивалентов 2.2.7. Титр 2.2.8. Расчет концентрации кристаллогидрата в растворе 2.2.9. Концентрация газа в растворе Газофазные растворы 21 2.3.1. Решение задач III. Процессы в растворах 23 3.1. Выпаривание 3.2. Осаждение из раствора 3.3. Произведение растворимости вещества 3.4. Разбавление растворов 3.5. Пересчет концентраций 3.6. Задачи для самостоятельного решения 26 IV. Электролитическая диссоциация 28 4.1. Степень и константа диссоциации 4.2. Диссоциация воды. рН раствора 4.3. Упражнения для самостоятельной работы V. Общие свойства растворов 30 5.1. Эбулиоскопия 5.2. Криоскопия 5.3. Осмос. Осмотическое давление 5.4. Изотонический коэффициент электролитов 5.5. Решение задач 5.6. Задачи для самостоятельного решения Вопросы и задачи по теме «Металлы» 44
Введение. Предмет химии. Основные понятия Химия – наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры. В химии широко пользуются понятием элемента – определённого вида атомов с одинаковым зарядом ядра (ионы, изотопы и т.д.). Значение заряда ядра атома служит отличительным признаком для различных видов атомов.. В настоящее время известно 114 элементов, но нас будут интересовать только природные 89 элемента от водорода Н до урана U. Вещество может быть простым, т.е. состоять из атомов одного элемента и сложным, т.е. представленным атомами различных элементов. Например, простыми являются газы – кислород O2 и озон O3, а вода H2O – сложное вещество.
Атом –это наименьшая частица элемента, входящая в состав молекул простых и сложных веществ. Молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и строением. С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Массы атомов чрезвычайно малы. Так, например, масса атома водорода составляет 1.674×10-27 кг, а масса атома урана 3.953×10-25 кг. В химии традиционно используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята атомная единица массы (а.е.м.), которая представляет собой 1/12 часть массы атома изотопа углерода 12C, что составляет 1.66054×10-27 кг. Поэтому относительной атомной массой Ar химического элемента называется величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12C. Например, относительная атомная масса урана составляет
Современные значения атомных масс приведены в Периодической системе элементов. Относительной молекулярной массой Mr вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава элемента к 1/12 массы атома углерода 12C. Относительная молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Например,
В Международной системе единиц (СИ) за единицу количества вещества принят моль. Чтобы научиться пользоваться этой величиной, сначала определим элементарную единицу вещества. Определим число атомов точно в 12 г 12С:
Это число называется постоянной Авогадро (NA). Теперь можно сказать, что 1 моль любого вещества – это такое его количество, которое содержит NA элементарных единиц. Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность г/моль. Обычно её обозначают буквой M. Молярная масса вещества, выраженная в г/моль, численно равна относительной атомной или относительной молекулярной массе этого вещества. Например, молярная масса газообразного кислорода M (O2) = 2×16 = 32 г/моль, а самородного золота M (Au) = 197 г/моль. Газы при низких давлениях можно описать как ансамбль несвязанных друг с другом молекул (идеальный газ). Идеальные газы подчиняются закону Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Если известна масса или количество газа, а надо вычислить его объём, или наоборот, используют уравнение Менделеева-Клапейрона: где p – давление газа, Па; V – его объём, м3; T – температура в абсолютной шкале, K; n – количество вещества газа, моль; m – масса, г; M – молярная масса газа, г/моль; R = 8.31441 Дж/(моль×К) – универсальная газовая постоянная. При нормальных условиях (температуре 273.15 К и давлении 101325 Па) один моль идеального газа занимает объём равный 22.41 л.
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям. Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами [i], называют химическими превращениями, химическими реакциями или химическими взаимодействиями. При записи уравнения химической реакции следует помнить, что в соответствии с законом сохранения массы число атомов каждого типа, вступающих в реакцию, должно быть равно числу атомов этого же типа в продуктах реакции (баланс массы). Если в реакции участвуют заряженные частицы (ионы), то следует также учитывать баланс заряда. Например, уравнение реакции окисления иона Mn2+ кислородом воздуха запишется в виде 2×Mn2+ + O2 + 2×H2O Þ 2×MnO2 + 4H+ Коэффициенты, стоящие в этом уравнении перед формулами соединений, называются стехиометрическими и необходимы для выполнения условий баланса масс и зарядов. Решение типовых задач Задача. Рассчитайте массу одной молекулы C2H5OH в кг. Решение. Используя периодическую систему, рассчитаем молярную массу нашего вещества M (C2H5OH) = 2× Mr (C) + 5× Mr (H) + Mr (O) + Mr (H) = 2×12.011 + 5×1.008 + 15.999 + 1.008 = 46.069 г/моль = 46.069×10-3 кг/моль. Полученный результат означает, что масса NA молекул этанола равна 46.069×10-3 кг. Следовательно, масса одной молекулы составляет
Задача. Сколько молекул содержится в 40 л азота при нормальных условиях? Решение. 1 моль газообразного азота при нормальных условиях занимает объём 22.41 л. Значит, количество азота в 40 л равно n = 40/22.41 =1.785 моль, которому соответствует n × NA = 1.785×6.022×1023 = 1.075×1024 молекул. Кислотные оксиды Кислотными оксидами можно назвать оксиды, которым соответствуют кислоты. Так, оксиду серы (VI) SO3 соответствует серная кислота H2SO4, высшему оксиду марганца (VII) Mn2О7 - марганцевая кислота HMnO4. (а). Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды: CO2 + 2NaOH = Na2CO3 + H2O для написания формулы соли надо знать, [H2CO3] какая кислота соответствует данному оксиду N2O5 + Ba(OH)2 = Ba(NO3)2 + H2O; SO3 + Ca(OH)2 = CaSO4 + H2O [ HNO3] [H2SO4] (б). Кислотные оксиды вступают во взаимодействие с оснόвными оксидами с образованием солей: CaO + CO2 = CaCO3; 3Na2O + P2O5 = 2Na3PO4. (в). По отношению к воде кислотные оксиды могут быть хорошо и плохо растворимыми. К растворимым оксидам относятся оксид углерода (IV) СО2, оксиды серы и др. К плохо растворимым кислотным оксидам принадлежат оксид кремния SiO2, оксид молибдена МоО3 и т.п. При растворении в воде образуются кислоты: CO2 + H2O = Н2СО3; SO3 + H2O = H2SO4
Амфотерные оксиды Амфотерными, т.е. двойственными оксидами, называются такие, которые в зависимости от условий проявляют оснόвные или кислотные свойства. К ним относятся оксид бериллия ВеО (бромеллит), оксид алюминия Аl2О3 (корунд), ZnO и оксиды других элементов, лежащие на диагональной линии периодической системы. Двойственные свойства могут проявлять d - и f -элементы в промежуточных степенях окисления. Запишем реакции взаимодействия амфотерного оксида цинка с азотной кислотой НNО3 и калийной щелочью KОН с образованием соответствующих солей - нитрата цинка Zn(NO3)2 и цинката калия K2ZnO2. ZnO + 2×НNО3 Þ Zn(NО3)2 + Н2О ZnO + 2×KOH Þ K2ZnO2 + H2O Основания Основаниями называют сложные соединения, содержащие в своем составе гидроксильные группы ОН-. Например, гидроксид лития LiOH и гидроксид меди Сu(OH)2 являются основаниями. Кислотность основания определяется числом его гидроксильных групп. Например, KOH – однокислотное основание, Ca(ОН)2, - двухкислотное, Sc(ОН)3 – трёхкислотное и т.д. Основания, растворимые в воде, называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов. Все остальные - плохо растворимые. К ним принадлежат основания s 2-, d - и f -элементов. a). Все основания взаимодействуют с кислотами, образуя соль и воду. Данные реакции называются реакциями нейтрализации: KOH + HCl = KCl + H2O; Fe(OH)2 + H2SO4 = FeSO4 + 2H2O Cu(ОН)2 + 2×СН3СООН Þ Cu(СН3СОО)2 + 2×Н2О б) Основания реагируют с кислотными оксидами. Ca(OH)2 + CO2 Þ CaCO3 + H2O в) Растворы щелочей реагируют с солями. В результате реакции должен образоваться осадок: 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 г) Амфотерные основания реагируют с щелочами и кислотами: Al(OH)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия, комплексная соль) 1.3 Кислоты. Основные понятия и определения Кислотами называются сложные соединения, имеющие в своем составе из катионов ионы водорода Н+. Основность кислоты определяется числом катионов водорода. Так, HCl – одноосновная кислота, H2S - двухосновная, H3PO4 – трёхосновная. Кислоты вступают во взаимодействие с оснόвными оксидами. Например, уравнения реакций взаимодействия оксида ванадия (II) с соляной кислотой и оксида ванадия (III) с серной кислотой запишутся в виде реакций: 2×HCl + VО Þ VCl2 + Н2О 3×Н2SО4 + V2О3 Þ V2(SО4)3 + 3×Н2О Кислоты реагируют с амфотерными оксидами с образованием соли и воды: 2HNO3 + ZnO = Zn(NO3)2 + H2O Кислоты реагируют с нормальными (оснόвными) солями: HCl + AgNO3 = AgCl↓+ HNO3; 2NaCl + H2SO4 = 2HCl↑ + Na2SO4 Кислоты реагируют с основаниями с образованием соли и воды. Запишем уравнение реакции взаимодействия фосфорной кислоты с гидроксидом калия Н3РО4 + 3КОН Þ К3РО4 + 3Н2О Активные металлы вытесняют из водных растворов кислот газообразный водород, образуя соответствующую соль: Fе + Н2SО4 Þ FeSO4 + H2 Химические свойства солей а) Соли взаимодействуют с металлами. Данный металл может вытеснять из раствора соли только те металлы, которые находятся правее его в электрохимическом ряду напряжений: Li(самый активный), Rb, K, Cs, Ra, Ba, Sr, Са, Na, Ac, La, Y, Mg, Sc, Be, Al Ti, Mn, Cr, Zn, Ga, Fe, Cd, In, Co, Ni, Sn, Pb, H2
Sb, Re, Bi, Cu, Hg, Ag, Rh, Pd, Pt, Au(самый неактивный) Fe + CuSO4 = FeSO4 + Cu; железо более активный металл, чем медь. б) Растворы солей реагируют с щелочами (обязательно образование осадка): K2CO3 + Ba(OH)2 = BaCO3↓ + 2KOH; 2Аl2(SO4)3 + 6CsOH Þ 2Al(OH)3¯ + 3Cs2SO4 в) Растворы солей реагируют с кислотами (обязательно образование осадка): BaCl2 + H2SO4 = BaSO4↓ + 2HCl Оснόвные соли взаимодействуют с кислотами с образованием солей: CuOHCl + HCl = CuCl2 + H2O; Fe(OH)2NO3 + HNO3 = FeOH(NO3)2 + H2O Кислые соли при реакции с щелочами образуют средние соли и воду: NaHSO3 + NaOH = Na2SO3 + H2O б) Растворы солей реагируют с солью (обязательно образование осадка): AgNO3 + KCl = AgCl↓ + KNO3 Растворимые соли вступают в обменные взаимодействия при образовании малорастворимого соединения. Например, АgNО3 + НСl = AgCl¯ + HNO3 Двойные и комплексные соли Двойные соли [ KAl(SO4)2; NH4Fe(SO4)2] образуются при соединении нейтральных молекул разных веществ друг с другом: K2SO4 + Al2(SO4)2 = K2SO4▪Al2(SO4)3 [2KAl(SO4)2] (NH4)2SO4 + Fe2(SO4)3 = (NH4)2SO4▪Fe2(SO4)3 [2NH4Fe (SO4)2] Многие минералы – это двойные соли. Комплексные соли {[ Cu(NH3)4]SO4; K3[Fe(CN)6]} образуются в результате взаимодействия иона – комплексообразователя (ион металла) с лигандами, противоположно заряженными ионами или нейтральными молекулами. Ион – комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения, которую обозначают квадратными скобками. Ионы, не вошедшие во внутреннюю сферу, образуют внешнюю сферу. Если ион – комплексообразователь – катион, то во внешней сфере находятся анионы: [Cu(NH3)4]2+SO42─; [Ag(NH3)2]+1Cl─ Если ион – комплексообразователь – анион, то во внешней сфере находятся катионы: 4К+ [Fe(CN)6]4─, Na1+ [Ag(CN)2]1─ Существуют нейтральные комплексы, например: [Co(NH3)3Cl3]0. Число лигандов (аддендов), которые координируются вокруг центрального иона – комплексообразователя, называют координационным числом. Координационные числа для ионов металлов приведены в таблице.
Отметим, что хлорофилл – комплексное соединение магния, гемоглобин – комплексное соединение железа, витамин В12 – комплексное соединение кобальта. Названия некоторых комплексных солей: K3[Fe(CN)6] – гексацианоферрат (Ш) калия [Ag(NH3)2]Cl – хлорид диамминсеребра (I). Двойные соли отличаются от комплексных характером диссоциации в водных растворах. Двойные соли диссоциируют в одну ступень на катионы обоих металлов и анион кислотного остатка: KAl(SO4)2 = K+ + Al3+ + 2SO42─ Комплексные соли при диссоциации образуют устойчивые комплексные ионы: [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42─ Решение типовых задач Задача. С какими из приведённых ниже веществ реагирует концентрированная азотная кислота? 1) Zn 2) NaOH 3) H2SO4 4) Al 5) NaCl р-р 6) K2SO4 7) CaCO3 8) AgNO3 9) Zn(OH)2 Решение. Очевидно, кислота будет реагировать с основаниями NaOH и Zn(OH)2 с образованием слабо диссоциирующей H2O: HNO3 + NaOH Þ NaNO3 + H2O 2×HNO3 + Zn(OH)2 Þ Zn(NO3)2 + 2×H2O Взаимодействие с CaCO3 будет протекать интенсивно, в результате образуется слабая угольная кислота и выделяется газ. HNO3 + CaCO3 Þ Ca(NO3)2 + H2CO3 Þ Ca(NO3)2 + H2O + CO2 По этой же причине реакции с H2SO4, NaCl р-р и AgNO3 протекать не будут: возможное обменное взаимодействие не приводит к образованию слаборастворимых соединений. Азотная кислота является окислителем. При взаимодействии с Zn происходит его окисление, а азот восстанавливается Zn + 4HNO3(конц.) Þ Zn(NO3)2 + 2NO2 + 2H2O Аналогичная реакция с Al не протекает, поскольку на поверхности металла образуется прочная оксидная плёнка (пассивация поверхности). Задача. Смешали растворы следующих соединений: · 1) KCl + NaNO3 · 2) NaOH + HNO3 · 3) CaCl2 + NaOH + Na2CO3 · 4) HCl + NaHCO3 · 5) HCl + Na2SO4 II. Растворы 2.1 Основные определения и понятия химии растворов Раствором называется однородная (гомогенная) система переменного состава. Под растворимостью понимают массу вещества, способной при данной температуре раствориться в 100 г растворителя. В зависимости от агрегатного состояния растворителя различают газофазные, жидкие и твердые растворы. В термодинамике различают растворы по степени межмолекулярного взаимодействия компонентов раствора. Термодинамическая классификация растворов: идеальные, разбавленные и реальные. В гидрогеохимии растворы различают по степени минерализации раствора. Минерализация раствора m(г/кг) - это суммарное масса растворенных веществ (в граммах) в одном килограмме воды. Установлена следующая классификация вод, см. таблицу:
Пресные воды и частично солоноватые можно отнести к разбавленным растворам, соленые воды - к реальным растворам. Природные растворы образуются в результате растворения в воде компонентов земной коры и газов. В гидрогеохимии для записи качественного и количественного состава раствора пользуются формулой Курлова (в виде дроби) В числители дроби указываются анионы, в знаменатели – катионы, входящие в состав раствора. Количественное содержание ионов дается в процентах от общего количества эквивалентов катионов и анионов. Грамм - эквивалент иона рассчитывается как отношение молярной массы иона к его заряду, эквивалент равен отношению массы иона к г - экв. В формуле Курлова перед дробью записывается общая минерализация природного раствора в промилле. (промилле растворенного вещества – количество растворенного вещества в граммах на 1 кг воды). Задача. Записать формулу Курлова для морской воды состава (в г/1кг воды)
Вычисляем г-экв катионов и анионов, количество их эквивалентов (экв = г/г-экв) и процентное содержание эквивалентов.
Рассчитаем общую минерализацию морской воды в г/кг Н2О: m = 12,86 + 22,26 = 35,12. Запишем формулу Курлова: Хлорид натрия NaCl придаёт воде соленый вкус, сульфат магния MgSO4- горький вкус.
Газофазные растворы Пример газофазного раствора – воздух. Состав воздуха – 21% кислорода, 78% - азота, 1% - остальные газы. Средняя молярная масса воздуха – 29. Для смеси газов справедлив закон Дальтона: давление газовой смеси равно сумме парциональных давлений всех входящих в неё газов Р = ∑рi. Если объем газовой смеси V, тогда парциальное давление компонента газовой смеси равно давлению этого компонента при условии, что он один занимает весь объем V. Тогда
Газовые уравнения и законы. Уравнение Клапейрона – Менделеева: Cm – молярная концентрация раствора. P = CmRT [P] = кПа; [m] – масса газа, граммы; R = 8,314 [Дж/(моль×К], [V] = литр.
Уравнение Клапейрона – Менделеева для смеси газов:
[P] = кПа; [m] – масса газа, граммы; R = 8,314 [Дж/(моль×оК], [V] = литр.
Законы Авагардо: 1 моль любого газа содержит 6,022×1023 молекул; При н.у. [T = 273,15оK, P = 101325 Па = 1,013 бара] один моль газа занимает объем 22,4 литра. Плотность газа при н.у. Решение задач Задача. Сухой воздух имеет состав 78,09% N2, 20,95% О2, 0,93% Ar и 0,03% СО2. Определить массу сухого воздуха в комнате объемом V = 40 м3 при t = 22оC и нормальном давлении Ро = 101,325 кПа. Решение: уравнение для смеси газов Msr = ∑δi×Mi = 0,7809×28 + 0,2095×32 + 0,0003×44 = 29
Задача. В баллоне объемом 2000 м3 смешали 1кг N2, 2 кг О2 и 3 кг Н2. Вычислить парциальные объемы газов и парциальные давления газов в баллоне при 17оС. TоK = 273 + 17 = 290оC. Решение: парциальное давление газа в баллоне парциальный мольный объём газа давление газов в баллоне P = (∑ni ×RT)/V Число молей газа в баллоне:N = ∑ni = 1000/28,02 + 2000/32 + 3000/2 = 35,71 + 62,5 + 1500 = 1598,21 Давление газов в баллоне Р = [1598,21×8,314×290]/(2000×1000) л = 1,927кПа. Парциальное давление газа:
Парциальный мольный объем газа:
Задача. Вычислить, ск. литров воздуха потребуется для сжигания 10 кг угля, содержащего 1% примеси. Кислорода в воздухе 20%. Решение: С + О2 = СО2. Масса углерода в 10 кг угля 10×0,99 = 9,9кг. При сжигании 1 моля угля (12г) потребуется 1 моль О2(32г); при сжигании 9,9кг угля (это 9900/12= 825молей) потребуется 825 молей кислорода, или 825/0,2 = 4125 молей воздуха. 1 моль воздуха это 22,4 л., 4125 молей это 92400 л или 92,4 м3.
III. Процессы в растворах Масса вещества в растворе: m = ρ×V×δ; m = C×M×V; m = H×Mэкв×V Выпаривание Вычислить процентную концентрацию раствора поваренной соли, полученном после выпаривания 300 г воды из 800 г раствора с 10% концентрацией соли. Решение: масса соли в 800 г раствора m = δ×m(раствора) = 0,1×800 = 80 г. После выпаривания масса раствора m = 800 – 300 = 500 г. Осаждение из раствора Задача. Вычислить, какая масса хлората калия KClO3 выкристаллизуется из 50 г насыщенного при 100оС раствора соли, если раствор охладить до 20оС. Растворимость хлората калия при 20оС равна 7,3 г/[100г Н2О], а при 100о – 56,2 г/[100г Н2О]. Решение: при 100оС раствор содержит 100г воды и 56,2г растворенной соли, поэтому масса раствора будет 100 + 56,2 = 156,2г. В 50г насыщенного раствора при 100оС воды будет m(г); составим пропорцию: в 156,2г раствора воды –100г в 50,0г раствора воды – m(г), откуда m = 32г, соли 50 – 32 = 18 г. Далее, пусть при 20оС в 32г воды растворится р(г) соли, а по условию задачи, в 100г воды растворяется 7,3г соли. Пропорция: в 32г воды растворится р(г) соли, в 100г воды растворится 7,3г соли, р = 2,3 г, масса соли, выкристаллизовавшейся после охлаждения раствора равна 18 – 2,3 = 15,7 г. Ответ: 15,7 г. Задача Ск. мл 0,2M раствора NaCl надо добавить к 150 мл 0,16H раствору AgNO3, чтобы осадить все находящееся в растворе серебро. Решение: 1×NaCl + 1×AgNO3 = 1×AgCl + 1×NaNO3; H(NaCl)×V(NaCl) = N(AgNO3)×V(AgNO3) H – нормальность раствора. Нормальность NaCl равна молялрной концентрации соли: 0,3×Vx = 0,16×150; Vx = 80 ml Задача. Вычислить объем 0,1М раствора карбоната натрия (Na2CO3), необходимого для осаждения ионов кальция (Са2+) из раствора, содержащего 0,324 г гидрокарбоната кальция Са(НСО3)2 Решение: Na2CO3+ Са(НСО3)2= 2NaHCO3 + CaCO3↓ Чтобы реакция протекала до конца, необходимо, чтобы 1 моль Na2CO3 (106 г) прореагировали с 1 молем Са(НСО3)2 (162 г). Для 0,324 г Са(НСО3)2 потребуется Х(г) Na2CO3: из пропорции 106↔162 X ↔ 0,324 X=0,212 г. Для осаждения 0,324 г ионов Са2+ потребуется 0,212 г Na2CO3 В 1 литре 0,1М раствора щелочи → 10,6 г Na2CO3 в V(л) “ должно быть → 0,212 г V = 0,02 л = 20 мл. Ответ: 20 млl. Задача. Вычислить массу осадка, выпадающего при слиянии 40мл 25% раствора NaOH (ρ = 1,27г/мл) и 60мл 0,5M раствора FeCl3. Решение: 1FeCl3 + 3NaOH = 1Fe(OH)3↓ + 3NaCl; M[FeCl3] = 161; M[NaOH]=40; M[Fe(OH)3]=107 На основании закона эквивалентности, для компонентов реакции должна выполняться пропорция: V1×H1 = V2×H2, где V и Н – объём и нормальность соответствующего раствора. Вычислим V×H для раствора щелочи. V = 40 мл,
Для соли FeCl3 V = 60 ml, k = 3, H = k×C = 1,5. H×V = 90; следовательно, щелочи взято с избытком и pасчёт теперь поведем по FeCl3. Из уравнения реакции следует, что если в реакции расходуется 1 моль FeCl3, в осадок выпадает 1 моль Fe(OH)3 Вычислим, ск. молей соли прореагировало: n = m/M = C×V = 0,5×0,06 = 0,03 моля, значит, в осадок выпадет 0,03×107 = 3,21г Fe(OH)3. Ответ: 3,21 г. Задача. Вычислить массу осадка, который образуется при сливании 20мл BaCl2 и 15мл 0,2M раствора серной кислоты H2SO4. Решение: BaCl2 + H2SO4 = BaSO4↓ + 2HCl Чтобы реакция протекала до конца, необходимо выполнение пропорции: 20×Н = 15×0,1; H(BaCl2) = 0,075; C(BaCl2) = 2×0,075 = 0,15 моль/л. Следовательно, образуется 0,15 моля BaSO4. В 20мл 0,15M раствора масса BaSO4 Задача. Вычислить массу осадка, который образуется при слиянии 30 мл 0,1M раствора CaCl2 и 20мл 0,2M раствора (NH4)2C2O4 M[CaCl2] = 110, M[(NH4)2C2O4] = 144, M[CaC2O4] = 128 Решение: CaCl2 + (NH4)2C2O4 = CaC2O4↓+ 2NH4Cl; вычислим число молей CaCl2 в 30 мл раствора: Разбавление растворов Имеем концентрированный раствор ρk; Vk; ωk. Надо приготовить раствор с ω < ωk, тогда воды в раствор надо добавить Задача. Ск. воды надо добавить к 0,5л 40% раствора NaOH (ρ = 1430 г/л), чтобы приготовить 10% раствор щелочи. Решение: воды надо добавить Задача. Вычислить процентную концентрацию раствора (ω%) NaOH, полученном при разбавлении 0,2 литра 2,5М раствора в 5 раз. M(NaOH) = 40 Решение: щелочи в исходном растворе m = C×M×V = 2,5×40×0,2 = 20г. Масса раствора после разбавления 200×5 = 1000 г. Задача. Сколько мл 0,1М раствора KMnO4 надо взять для приготовления 120мл 0,02М раствора. Решение: H1×V1 = H2×V2: Vx×0,1 = 120×0,02; Vx = 24 мл. Исходный раствор надо разбавить в 120/24 = 5 раз. Задача. Вычислить нормальность раствора щелочи NaOH, если 100 г 40% раствора щелочи разбавили водой до 500 мл Решение: в 100 г 40% раствора щелочи было 40 г. H = C/1 = Задача. Какой объем раствора с δ = 9,3 кислоты H2SO4 с ρ = 1,05 (г/мл) потребуется, чтобы приготовить 0,35М раствор кислоты объемом 40мл. Решение: Vδ×ρ δ = VC C×M; Задача. Вычислить объем 2М раствора серной кислоты, приготовленного из 49 мл 98% раствора H2SO4 (ρ = 1,84 г/мл). Решение: Задача. Ск. потребуется (мл) 63% раствора HNO3 (ρ= 1,35г/мл) для приготовления 500мл 0,5M раствора кислоты M(HNO3) = 63. Решение: Задача. Какой объем 2М раствора вещества надо взять, чтобы получить 0,5 литра 0,1М раствора. Решение: 2×Vx = 0,5×0,1; Vx = 0,025 л = 25 мл. Пересчет концентраций. Если δ – массовая доля компонент
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.192.113 (0.013 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

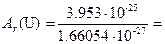 238.06.
238.06.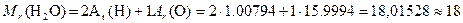
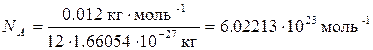
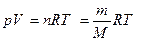 ,
,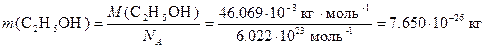
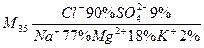 .
.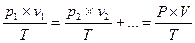 и v1 + v2 + v3 + … = V
и v1 + v2 + v3 + … = V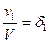 объемная доля газа, входящего в состав смеси газов:
объемная доля газа, входящего в состав смеси газов: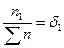 молярная доля газа;
молярная доля газа; 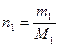 число молей газа 1; М1 = молярная масса газа 1.
число молей газа 1; М1 = молярная масса газа 1.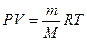 ,
, 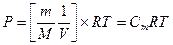 ;
;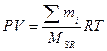 , MSR = M1×δ1+ M2×δ2 + M3×δ3 + ..средняя мол. масса смеси газов
, MSR = M1×δ1+ M2×δ2 + M3×δ3 + ..средняя мол. масса смеси газов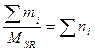 - число молей газа в смеси, P×V = ∑ni ×RT
- число молей газа в смеси, P×V = ∑ni ×RT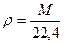 [г/л].
[г/л].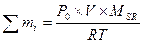
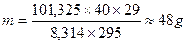 Ответ: 48 г.
Ответ: 48 г.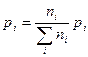
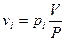
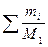 =
=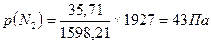 , р(О2) =75Па, р(Н2) = 1809Па
, р(О2) =75Па, р(Н2) = 1809Па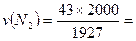 44,6 м3, v(O2)=77,84 м3, v(H2) = 1877,53 м3
44,6 м3, v(O2)=77,84 м3, v(H2) = 1877,53 м3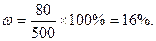
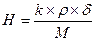 ; для NaOH k = 1, ρ = 1270 г/л, δ=0,25, М=40. Н=7,94, H×V ≈ 318
; для NaOH k = 1, ρ = 1270 г/л, δ=0,25, М=40. Н=7,94, H×V ≈ 318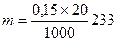 =0,699 г.
=0,699 г.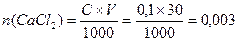 . Число молей (NH4)2C2O4 в 20 мл раствора
. Число молей (NH4)2C2O4 в 20 мл раствора 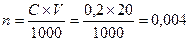 , т.е. (NH4)2C2O4 в избытке, следовательно, расчет следует вести по CaCl2; В реакции хлорида кальция прореагировало 0,003 моля, CaC2O4 образовалось так же 0,003 моля или 0,003×128 = 0,384 г = 384 мг.
, т.е. (NH4)2C2O4 в избытке, следовательно, расчет следует вести по CaCl2; В реакции хлорида кальция прореагировало 0,003 моля, CaC2O4 образовалось так же 0,003 моля или 0,003×128 = 0,384 г = 384 мг.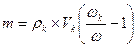 (грамм)
(грамм)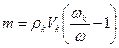
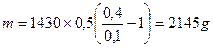
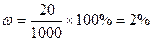
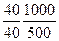 = 2
= 2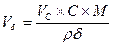 ;
; 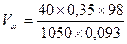 = 14 мл
= 14 мл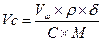 ;
; 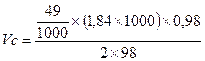 = 0,45(литр)
= 0,45(литр)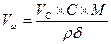 =
= 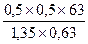 = 18,5 мл
= 18,5 мл


