
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Произведение растворимости вещества (ПР)
Произведением растворимости вещества называется произведение концентраций ионов, которые образуются в результате реакции диссоциации вещества в соответствующих степенях в насыщенном растворе. Например: реакция диссоциации доломита CaMg(CO3)2 = Ca2+ +Mg2+ + 2CO32−; ПР(CaMg(CO3)2) = [Ca2+]×[Mg2+]×[CO32−]2. Т.к. понятия ПР вещества и константы равновесия реакции диссоциации (К) вещества совпадают, т.е. ПР = К, вычислить ПР можно по уравнению Вант – Гоффа: Задача. Вычислить массу карбоната бария (BaCO3), содержащегося в 10 л насыщенного раствора. ПР(BaCO3) = 4×10–10 Решение: реакция диссоциации BaCO3 = Ba2+ + CO32–, [Ba2+] = [CO32–] следовательно (197,5 молярная масса BaCO3). Ответ: 39,4 мг Задача. После выпаривания воды из 15,0 г раствора Ag3PO4получено 0,0001г безводной соли. Вычислить ПР(Ag3PO4). Решение: запишем выражение для ПР соли: Ag3PO4 = 3 Ag+ + PO43−, ПР = [Ag+]3×[PO43−] Вычислим молярную концентрацию соли в растворе: [PO43−] = 1×1,6×10−5, ПР(Ag3PO4) = 1,8×10−18. Задача. Оценить растворимость флюорита CaF2, если ПР(CaF2) = 2,14×10−12. Решение: реакция диссоциации флюорита: CaF2 = Ca2+ + 2F−. Пусть флюорита растворилось n(молей). Тогда в растворе будет n(моль) Са2+ и 2n(моль) F−. ПР(CaF2) = [Ca2+]1×[F−]2 = n×4n2 = 4n3. 4n3 = 2,14×10−12; n ≈ 8,2×10−5 моля. M(CaF2) = 78. 8,2×10−5 ×78=6,4 мг. В 1000 г воды растворится 6,4 мг флюорита. Задача. Раствор содержит нитраты кадмия и железа(II) в равных концентрациях. Гидроксид какого элемента выпадет в осадок первым при добавлении щелочи, если ПР(Cd(OH)2) = 2×10−14, ПР(Fe(OH)2) = 1×10−15. Каким должно быть соотношение концентраций нитратов, чтобы при добавлении щелочи оба гидроксила начали выпадать в осадок одновременно? Решение: гидроксид того элемента выпадет в осадок первым, ПР которого меньше, т.е. первым в осадок выпадет гидроксид железа. Чтобы оба гидроксида начали выпадать в осадок одновременно, надо чтобы концентрация вводимой щелочи удовлетворяла одновременно обоим значениям ПР. Следовательно, равновесная концентрация ионов ОН− в растворах гидроокиси кадмия и железа должна быть одинаковой:
если Разбавление растворов Имеем концентрированный раствор ρk; Vk; ωk. Надо приготовить раствор с ω < ωk, тогда воды в раствор надо добавить Задача. Ск. воды надо добавить к 0,5л 40% раствора NaOH (ρ = 1430 г/л), чтобы приготовить 10% раствор щелочи. Решение: воды надо добавить Задача. Вычислить процентную концентрацию раствора (ω%) NaOH, полученном при разбавлении 0,2 литра 2,5М раствора в 5 раз. M(NaOH) = 40 Решение: щелочи в исходном растворе m = C×M×V = 2,5×40×0,2 = 20г. Масса раствора после разбавления 200×5 = 1000 г. Задача. Сколько мл 0,1М раствора KMnO4 надо взять для приготовления 120мл 0,02М раствора. Решение: H1×V1 = H2×V2: Vx×0,1 = 120×0,02; Vx = 24 мл. Исходный раствор надо разбавить в 120/24 = 5 раз. Задача. Вычислить нормальность раствора щелочи NaOH, если 100 г 40% раствора щелочи разбавили водой до 500 мл Решение: в 100 г 40% раствора щелочи было 40 г. H = C/1 = Задача. Какой объем раствора с δ = 9,3 кислоты H2SO4 с ρ = 1,05 (г/мл) потребуется, чтобы приготовить 0,35М раствор кислоты объемом 40мл. Решение: Vδ×ρ δ = VC C×M; Задача. Вычислить объем 2М раствора серной кислоты, приготовленного из 49 мл 98% раствора H2SO4 (ρ = 1,84 г/мл). Решение: Задача. Ск. потребуется (мл) 63% раствора HNO3 (ρ= 1,35г/мл) для приготовления 500мл 0,5M раствора кислоты M(HNO3) = 63. Решение: Задача. Какой объем 2М раствора вещества надо взять, чтобы получить 0,5 литра 0,1М раствора. Решение: 2×Vx = 0,5×0,1; Vx = 0,025 л = 25 мл. Пересчет концентраций. Если δ – массовая доля компонента раствора, ρ(г/л) плотность раствора, V1 – объём раствора, С(моль/л) – молярная концентрация раствора, М – молеку- лярная масса компонента в растворе, V2 – объём раствора, тогда
δ×ρ× V 1 = С×М × V 2. Задача. Вычислить молярную концентрацию раствора, если к V1 = 1,5л кислоты с С1= 2М добавить V2 = 0,5л кислоты с С2 = 4М. Решение: 3.6 Задачи для самостоятельного решения I. Массовая доля; процентная концентрация. 1.1. Вычислить процентную концентрацию раствора, если масса растворенного вещества 21,04 г., объем раствора 0,2 л., плотность раствора 1,052 г/мл. 1.2. Соду массой 5 г растворили в 20 г воды. Вычислить массовую долю соды в растворе. 1.3. Сколько нитрата калия и воды необходимо взять для приготовления 2 кг раствора с массовой долей соли 0,05. 1.4. К 250 г 10% раствора CaCl2 прилили 150 мл воды. Вычислить массовую долю соли в полученном растворе. 1.5. Какую массу иода и спирта потребуется для приготовления 5% раствора иода массой 300 г. 1.6. Соль массой 1 кг растворили в воде объемом 5 л. Вычислить процентную концентрацию полученного раствора. 1.7. К 120 г раствора соли с массовой долей вещества 0,14 прилили 180 мл воды. Вычислить процентную концентрацию полученного раствора. 1.8. К 40 г раствора соли с ω = 8% прилили 20 г раствора соли с ω = 5%. Определить процентную концентрацию полученного раствора. 1.9. Соль массой 1000 г растворили в воде и получили 25% раствор. Вычислить массу воды в растворе. 1.10. Вычислить плотность 10% раствора, объемом 500 мл, если масса растворенного вещества 20 г. 1.11. Вычислить массу кислоты, растворенной в 200 мл воды, если получили 20% раствор плотностью 1,05 г/мл. II. Молярная концентрация раствора. 2.1. В растворе объемом 500 мл растворили 5 г щелочи NaOH. Определить молярную концентрацию раствора. 2.2. Вычислить массу поваренной соли в растворе объемом 200 мл, если молярная концентрация раствора 2(моль/л). 2.3. Какая масса соли CuCl2 содержится в 15 л раствора, если молярная концентрация раствора 0,3 (моль/л). 2.4. Вычислить массу воды, которая потребуется, чтобы приготовить раствор сульфата натрия Na2SO4 с молярной концентрацией 0,4 (моль/л), если растворить 14,2 г соли. 2.5. В растворе объемом 500 мл растворили 5 г щелочи NaOH. Сколько щелочи надо добавить в раствор, чтобы молярная концентрацию раствора стала 0,75(моль/л). Считаем, что объем раствора после добавления щелочи измениться незначительно. III. Молярная концентрация + массовая доля. 3.1. Вычислить молярную концентрацию раствора серной кислоты, если плотность раствора 1,08 г/мл, процентная концентрация раствора 12%. 3.2. Молярная концентрация раствора щелочи КОН равна 3,8 моль/л, плотность раствора 1,17 г/мл. Вычислить процентную концентрацию щелочи в растворе. 3.3. К 300 мл 20% раствора серной кислоты плотностью 1,14 г/мл добавили 250 мл воды. Вычислить молярную концентрацию полученного раствора. 3.4. Вычислить процентную концентрацию раствора соли CuCl2, с молярной концентрацией раствора 0,3 (моль/л), плотностью раствора ρ = 1500(г/л) 3.5. Вычислить молярную концентрацию раствора соляной кислоты с ρ = 1,19(г/мл) и процентной концентрацией HCl 36%. 3.6. Вычислить объем 2М раствора серной кислоты, приготовленного из 49 мл 98% раствора H2SO4 с ρ = 1,84 г/мл. 3.7. Какой объем 2М раствора соли надо взять, чтобы приготовить 0,5 л 0,1М раствора. IY. Кристаллогидраты. 4.1. Какие массы кристаллогидрата Na2SO4•10 H2O (глауберова соль) и воды надо взять, чтобы приготовить раствор массой 71 г с концентрацией 20%.
4.2. Вычислить массу железного купороса FeSO4•7H2O, которая потребуется, чтобы приготовить 2 л раствора, с 10% концентрацией сульфата железа FeSO4 и плотностью раствора ρ = 1520 г/л. 4.3. Сколько можно получить кристаллогидрата Al2(SO4)3•18H2O, если упаривать 40% раствор сульфата алюминия Al2(SO4)3 объемом 250 мл и плотностью 1,368 г/мл. 4.4. Сколько надо растворить железного купороса FeSO4•7H2O, чтобы приготовить 1 л.раствора сульфата железа FeSO4 с молярной концентрацией 0,5(моль/л). 4.5. Вычислить процентную концентрацию сульфата кальция (CaSO4), если в 54,4 мл воды растворить 1,72 г гипса CaSO4×2H2O. 4.6. Вычислить массу кристаллогидрата MgSO4×7H2O необходимого для приготовления 1 кг 6% раствора сульфата магния MgSO4. 4.7. Вычислить, сколько надо взять медного купороса CuSO4×5H2O и воды, чтобы приготовить 300 г 10% раствора сульфата меди CuSO4. 4.8. Вычислить процентную концентрацию сульфата меди в растворе, полученном при растворении 50 г медного купороса CuSO4×5H2O в 350 мл воды. Y. Осаждение из раствора. 5.1 Вычислить массу осадка, который образуется при сливании 20 мл BaCl2 и 15 мл 0,2M раствора серной кислоты H2SO4. 5.2 Вычислить массу осадка, который образуется при слиянии 30 мл 0,1M раствора CaCl2 и 20 мл 0,2M раствора (NH4)2C2O4 5.3. Вычислить массу осадка, который образуется при слиянии 20 мл 0,1M раствора Ba(NO3)2 и 15 мл 0,2M раствора K2CO3 YI. Произведение растворимости вещества. 6.1 Вычислить ПР веществ: a) AgBr, AgI; b) CaSO4, Ca3(PO4)2; c) CuCO3, Cu(OH)2; d) FeCO3, FeS; e) MnCO3, MnS. 6.2 Вычислить ПР(СаСО3), если в 100 мл раствора содержится 6,5×10−4 г соли.
|
|||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.149.168 (0.035 с.) |
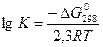 . ΔGо298 – стандартный изобарный потенциал реакции, R = 8,31441(Дж/(моль×оК) – газовая постоянная, [T] = температура раствора в градусах Кельвина.
. ΔGо298 – стандартный изобарный потенциал реакции, R = 8,31441(Дж/(моль×оК) – газовая постоянная, [T] = температура раствора в градусах Кельвина.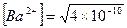 = 2×10–5 (моль /л), т.е. в 1 л раствора содержится 2×10–5 моля иона Ва2+. Из уравнения диссоциации барита следует, что число молей иона Ва2+ равно числу молей BaCO3, которые вступили в реакцию диссоциации. Следовательно, в 10 л раствора масса (BaCO3) = 2×10–5 ×10×197,35 = 0,0394 г = 39,4 мг.
= 2×10–5 (моль /л), т.е. в 1 л раствора содержится 2×10–5 моля иона Ва2+. Из уравнения диссоциации барита следует, что число молей иона Ва2+ равно числу молей BaCO3, которые вступили в реакцию диссоциации. Следовательно, в 10 л раствора масса (BaCO3) = 2×10–5 ×10×197,35 = 0,0394 г = 39,4 мг.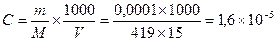 M. Следовательно, [Ag+] =3×1,6×10−5,
M. Следовательно, [Ag+] =3×1,6×10−5,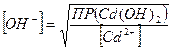 ;
; 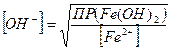 Эти концентрации будут равны,
Эти концентрации будут равны,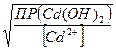 =
= 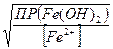 , или
, или 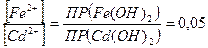 , т.е. если концентрация ионов железа, будет в 20 раз меньше, чем ионов кадмия.
, т.е. если концентрация ионов железа, будет в 20 раз меньше, чем ионов кадмия.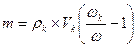 (грамм)
(грамм)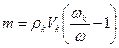
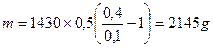
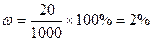
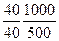 = 2
= 2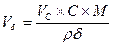 ;
; 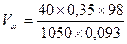 = 14 мл
= 14 мл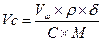 ;
; 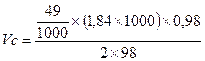 = 0,45(литр)
= 0,45(литр)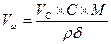 =
= 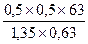 = 18,5 мл
= 18,5 мл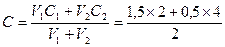 = 2,5М
= 2,5М


