Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И 130102 «Технология геологической разведки»
Москва 2014
Рецензент: доктор химических наук, проф. Н.Н. Акинфиев
Бицоев К.Б. Умрихин В.А. Общая химия: учебное пособие
Цель данного пособия – подготовить студентов РГГРУ всех специальностей к прохождению курса физической химии, который будет изучаться ими в течение второго и третьего семестров. В пособии весьма сжато излагаются основные понятия, представления и законы, необходимые для дальнейшего углубленного изучения химии и связанных с ней профильных дисциплин: геохимии, гидрогеологии, экологии, петрографии и др. В пособие включены следующие разделы химии: 1. Атомно-молекулярное учение. 2. Классы неорганических соединений. 3. Растворы. 4. Процессы в растворах. 5. Общие свойства растворов. 6. Окислительно-восстановительные реакции. 7. Дисперсные системы. Коллоиды. 8. Количественные расчеты в химии.
Оглавление Введение. Предмет химии. Основные понятия 5 I. Классификация неорганических соединении 7 I.1. Оксиды. Основные понятия и определения 7 1.1.1. Оснόвные оксиды 1.1.2. Кислотные оксиды 1.1.3. Амфотерные оксиды I.2 Основания 8 I.3 Кислоты. Основные понятия и определения 9 1.3.1. Химические свойства азотной кислоты 1.3.2. Химические свойства серной кислот 1.3.3. Химические свойства сероводородной кислоты I.4 Соли. Основные понятия и определения 10 1.4.1. Химические свойства солей 1.4.2. Двойные и комплексные соли I.5. Решение типовых задач 12 I.6. Упражнения для самостоятельной работы по теме: «Классификация неорганических соединений» II. Растворы 2.1. Основные понятия и определения. Классификация растворов 15 Способы выражения состава раствора 16 Концентрация компонента в растворе 2.2.1. Массовая доля растворенного вещества [δ]. 2.2.2. Процентное содержание вещества в растворе [ω%]
2.2.3. Мольная доля растворенного вещества [χ] 2.2.4. Молярная концентрация растворенного вещества [С(моль/л)] 2.2.5. Моляльная концентрация растворенного вещества [Сm(моль/(кг Н2О))] 2.2.6. Нормальная концентрация растворенного вещества [Н(моль/л)] a) Эквивалент растворенного вещества б) Решение задач с использованием закона эквивалентов в) Закон эквивалентов 2.2.7. Титр 2.2.8. Расчет концентрации кристаллогидрата в растворе 2.2.9. Концентрация газа в растворе Газофазные растворы 21 2.3.1. Решение задач III. Процессы в растворах 23 3.1. Выпаривание 3.2. Осаждение из раствора 3.3. Произведение растворимости вещества 3.4. Разбавление растворов 3.5. Пересчет концентраций 3.6. Задачи для самостоятельного решения 26 IV. Электролитическая диссоциация 28 4.1. Степень и константа диссоциации 4.2. Диссоциация воды. рН раствора 4.3. Упражнения для самостоятельной работы V. Общие свойства растворов 30 5.1. Эбулиоскопия 5.2. Криоскопия 5.3. Осмос. Осмотическое давление 5.4. Изотонический коэффициент электролитов 5.5. Решение задач 5.6. Задачи для самостоятельного решения VI. Окислительно – восстановительные реакции 32 6.1. Задачи для самостоятельного решения VII. Дисперсные системы. Основные понятия и определения 34 7.1. Классификация дисперсных систем 7.2. Коллоидные растворы (золи) 7.3. Строение мицеллы. Образование и строение различных золей 7.4. Строение мицеллы 7.5. Методы получения коллоидов и дисперсных систем 7.6. Электрокинетические явления в золях 7.7. Коагуляция коллоидных растворов 7.8. Задачи по теме дисперсные системы VIII. Металлы. Основные понятия и определения 38 8.1. Общие способы получения металлов 8.2. Химические свойства металлов 8.3. Отношение металлов к разбавленным и концентрированным кислотам
8.4. Амфотерные металлы 8.5. Жесткость воды 8.6. Коррозия металлов и защита от нее 8.7. Драгоценные металлы Вопросы и задачи по теме «Металлы» 44
Введение. Предмет химии. Основные понятия Химия – наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры. В химии широко пользуются понятием элемента – определённого вида атомов с одинаковым зарядом ядра (ионы, изотопы и т.д.). Значение заряда ядра атома служит отличительным признаком для различных видов атомов.. В настоящее время известно 114 элементов, но нас будут интересовать только природные 89 элемента от водорода Н до урана U. Вещество может быть простым, т.е. состоять из атомов одного элемента и сложным, т.е. представленным атомами различных элементов. Например, простыми являются газы – кислород O2 и озон O3, а вода H2O – сложное вещество. Атом –это наименьшая частица элемента, входящая в состав молекул простых и сложных веществ. Молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и строением. С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Массы атомов чрезвычайно малы. Так, например, масса атома водорода составляет 1.674×10-27 кг, а масса атома урана 3.953×10-25 кг. В химии традиционно используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята атомная единица массы (а.е.м.), которая представляет собой 1/12 часть массы атома изотопа углерода 12C, что составляет 1.66054×10-27 кг. Поэтому относительной атомной массой Ar химического элемента называется величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12C. Например, относительная атомная масса урана составляет
Современные значения атомных масс приведены в Периодической системе элементов. Относительной молекулярной массой Mr вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава элемента к 1/12 массы атома углерода 12C. Относительная молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Например,
В Международной системе единиц (СИ) за единицу количества вещества принят моль. Чтобы научиться пользоваться этой величиной, сначала определим элементарную единицу вещества. Определим число атомов точно в 12 г 12С:
Это число называется постоянной Авогадро (NA). Теперь можно сказать, что 1 моль любого вещества – это такое его количество, которое содержит NA элементарных единиц. Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность г/моль. Обычно её обозначают буквой M. Молярная масса вещества, выраженная в г/моль, численно равна относительной атомной или относительной молекулярной массе этого вещества. Например, молярная масса газообразного кислорода M (O2) = 2×16 = 32 г/моль, а самородного золота M (Au) = 197 г/моль. Газы при низких давлениях можно описать как ансамбль несвязанных друг с другом молекул (идеальный газ). Идеальные газы подчиняются закону Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Если известна масса или количество газа, а надо вычислить его объём, или наоборот, используют уравнение Менделеева-Клапейрона:
где p – давление газа, Па; V – его объём, м3; T – температура в абсолютной шкале, K; n – количество вещества газа, моль; m – масса, г; M – молярная масса газа, г/моль; R = 8.31441 Дж/(моль×К) – универсальная газовая постоянная. При нормальных условиях (температуре 273.15 К и давлении 101325 Па) один моль идеального газа занимает объём равный 22.41 л. Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям. Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами [i], называют химическими превращениями, химическими реакциями или химическими взаимодействиями. При записи уравнения химической реакции следует помнить, что в соответствии с законом сохранения массы число атомов каждого типа, вступающих в реакцию, должно быть равно числу атомов этого же типа в продуктах реакции (баланс массы). Если в реакции участвуют заряженные частицы (ионы), то следует также учитывать баланс заряда. Например, уравнение реакции окисления иона Mn2+ кислородом воздуха запишется в виде 2×Mn2+ + O2 + 2×H2O Þ 2×MnO2 + 4H+ Коэффициенты, стоящие в этом уравнении перед формулами соединений, называются стехиометрическими и необходимы для выполнения условий баланса масс и зарядов. Решение типовых задач Задача. Рассчитайте массу одной молекулы C2H5OH в кг. Решение. Используя периодическую систему, рассчитаем молярную массу нашего вещества M (C2H5OH) = 2× Mr (C) + 5× Mr (H) + Mr (O) + Mr (H) = 2×12.011 + 5×1.008 + 15.999 + 1.008 = 46.069 г/моль = 46.069×10-3 кг/моль. Полученный результат означает, что масса NA молекул этанола равна 46.069×10-3 кг. Следовательно, масса одной молекулы составляет
Задача. Сколько молекул содержится в 40 л азота при нормальных условиях? Решение. 1 моль газообразного азота при нормальных условиях занимает объём 22.41 л. Значит, количество азота в 40 л равно n = 40/22.41 =1.785 моль, которому соответствует n × NA = 1.785×6.022×1023 = 1.075×1024 молекул.
|
|||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 59; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.22.244 (0.02 с.) |
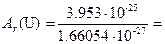 238.06.
238.06.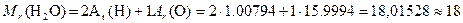
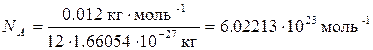
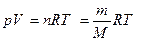 ,
,