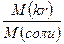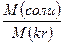Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задачи по теме дисперсные системы⇐ ПредыдущаяСтр 13 из 13
1. Указать, какие системы можно назвать дисперсными: а) раствор KCl в воде; б) рубины: в) коллоидные растворы; г) бетон. 2. Определить потенциал-определяющий ион при взаимодействии равных объмов 0,002М раствора BaCl2 и 0,001М раствора H2SO4. 3. Процесс нейтрализации электрического заряда и гидратной оболочки коллоидной частицы называется: а)коагуляцией б) седимендацией. 4. Диффузный слой золя Fe(OH)3, полученного при гидролизе FeCl3 образован ионами: а) ОН─;б) Cl─, в) Fe3+. Выбрать правильный ответ. 5. В коллоидной частице CuSO4изб + H2S = CuS↓ + H2SO4 потенциал опреде – ляющий ион а) HS–. б) S2─; в) Cu2+; г) SO42─. 6. Для золя CuS, полученного в реакции CuCl2 + H2Sизб = CuS↓ + 2HCl потенциалоопределяющий ион будет а) HS–, б) S2─; в) Cu2+; г) SO42─ Записать формулу мицеллы и указать заряд частицы: 1) AgNO3(изб) + KI = AgI↓ + KNO3 2). AgNO3 + KI(изб) = AgI↓ + KNO3 3) 2AgNO3(изб) + K2S = Ag2S↓ + 2KNO3 4). 2AgNO3 + K2S(изб) = Ag2S↓ + 2KNO3 5) Al2(SO4)3(изб) +2Na3PO4 = 2AlPO4↓ + 3Na2SO4 6) BaCl2 +Na2SO4(изб) = BaSO4↓ + 2NaCl 7) Ba(NO3)2 +H2SO4(изб) = BaSO4↓ + 2HNO3 8) CuSO4 (изб) +2NaOH = Cu(OH)2↓ + Na2SO4 9) CuSO4 + H2S(изб) = CuS + H2SO4 10). 2H3AsO3 + 3H2S(изб) = As2S3↓ + 6H2O 11) Na2SiO3 + 2HCl = H2SiO3 + 2NaCl 12). Pb(NO3)2(изб) + H2S = PbS↓ + 2HNO3
VIII. Металлы. Основные понятия и определения
Из 114 химических элементов (в 2012 году Международный союз теоретическо и прик-ладной химии утвердил названия ещё двух элеметов: №114 – флеровий (Fl) и №116 ливерморий (Lv) 89 являются «природными», из которых 22 являются неметаллами, а 67 – металлами. Металлы отличаются от неметаллов тем, что атомы металлов на внешнем слое имеют мало электронов, в основном – от одного до трёх. Поэтому атомы металлов в ходе химических реакций всегда отдают электроны, образуя положительно заряженные ионы – катионы. Что касается физических свойств, то металлы пластичны (М.В. Ломоносов определял металлы как «светлые тела, которые ковать можно»), являются твердыми веществами (кроме ртути), характеризующиеся хорошими тепло- и электропроводными свойствами (самыми электропроводными являются серебро, медь, золото и алюминий). Плотность металлов варьирует в широких пределах: от 0,54 г/см3 у лития до 22,54 г/см3 у осмия; температуры плавления – от 28,4 оС у цезия до 3420 оС у вольфрама; по твердости металлы весьма различаются: если натрий можно разминать между подушечками пальцев, то твердость хрома равна 9 (напомним, что твердость алмаза равна 10). Все металлы серебристо-белого цвета, кроме золота (соломенно-желтое) и меди (красная).
Металлы по химическим свойствам делятся на группы: s-металлы (щелочные и щелочноземельные) – самые химически активные, р-металлы – малоактивные (галлий, германий, мышьяк) и переходные d- и f-металлы – переходные от самых активных к малоактивным; это 4 декады d-металлов 21Sc – 30Zn, 39Y – 48Cd, 57La – 80Hg, 89Ас – 112Сn и 2 ряда f-металлов по14 элементов в каждом – это лантаноиды и актиноиды. Кроме этой классификации, в технике существует ещё деление на группы: - черные металлы – это железо и его сплавы; - тяжелые металлы (с плотностью более плотности железа 7,87 г/см3 ) – Сu, Рb, Sn, Zn, Ni, Co, Sb, Bi, Hg, Cd, большинство которых токсичные; - легкие металлы (с плотностью менее 5 г/см3): Al, Mg, Ca, Ti и др. - драгоценные металлы - Au, Ag, Pt и платиновые металлы. По распространенности в природе химических элементов картина следующая. Мы уже отмечали, что всего природных элементов 89, но только 9 из них составляют около 99% массы земной коры, причем семь из девяти – это металлы. Вот как расположены эти элементы по содержанию в земной коре: О – 47%, Si – 29%, Аl – 8,05%, Fe – 4,65%,Са – 2,96%, Na – 2,5%, К – 2,5%, Мg – 1,9%, Тi – 0,45%. Все остальные элементы относятся к редким. Они встречаются в природе большей частью в виде химических соединений с другими элементами. Некоторые металлы встречаются в самородном состоянии – это золото, серебро, платина и платиновые металлы, встречается ртуть самородная. 8.1 Общие способы получения металлов. Прежде всего рассмотрим способы получения «главного» металла железного века – железа. Основные минералы железа – это оксиды гематит Fe2O3 и магнетит Fe3O4, пирит FeS2 и сидерит FeCO3. Природные оксиды восстанавливаются в доменных печах оксидом углерода: Fe2O3 + 3CO = 2Fe + 3CO2 Если же исходным сырьем является пирит, то его предварительно обжигают: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 В случае сидерита начинают с процесса термического разложения: FeCO3 = FeO + CO2
Восстановлением полученных оксидов получают железо: FeO + C = Fe + CO2 Другие металлы встречаются в природе тоже в виде соединений. Но есть и металлы, которые встречаются в самородном состоянии. Так, например, золото и платина встречаются почти исключительно в самородном состоянии, серебро и медь – иногда; бывает ртуть самородная. Золото и платину получают посредством механического отделения от породы промывкой водой или другими реагентами, переводящими их в раствор с последующим извлечением из раствора. Основным методом получения золота в золотодобывающих странах в настоящее время является цианидный метод. Обогащенную руду обрабатывают водным раствором цианида натрия с продувкой кислорода: 4Аu + 8NaCN + O2 + H2O = 4Na[Au(CN)2]+ 4NaCN Образовавшийся раствор дицианоаурата натрия обрабатывают цинковой пылью: 2Na[AuCN)2] + Zn = Na2[Zn(CN)4] + 2Au↓ Избыток цинка растворяют разбавленной серной кислотой, а мелкодисперсное золото отделяют от раствора, промывают водой, высушивают и подвергают плавке. Разумеется, не все металлы можно получить восстановлением их оксидов углем или оксидом углерода СО. В таких случаях применяют более сильные восстановители (Н2, Mg, Al, Si): Cr2O3 + 2Al = 2Cr + Al2O3 Sc2O3 + 3Mg = 2Sc + 3Mg Восстановление водородом обеспечивает наибольшую чистоту получаемого металла. Так получают вольфрам и очень чистое железо: WO3 + 3H2 = W + 3H2O Fe2O3 + 3H2 = 2Fe + 3H2O Некоторые металлы получают исключительно электрохимическим восстановлением из расплавов солей. Например, катодным восстановлением получают щелочные и щелочно-земельные металлы, алюминий, цинк и др.: Na+ + e-= Nao Ca 2+ + 2e-= Cao Al3+ +3e-= Alo Ежегодное мировое производство металлов колеблется от сотен миллионов тонн железа и его сплавов до порядка 2 000 тонн золота. 8.2 Химические свойства металлов. Все металлы характеризуются способностью отдавать валентные электроны и, стало быть, образовывать положительно заряженные ионы – катионы: Nao – e- = Na+ Cao – 2e-= Ca2+ Alo – 3e- = Al3+ Постоянную валентность и степень окисления проявляют только типичные металлы, а именно металлы главных подгрупп I и II групп – щелочные и щелочноземельные. Большинство металлов других групп проявляют переменные валентности и степени окисления. При этом в низших степенях окисления они проявляют металлические свойства, образуя оснόвные оксиды и гидроксиды – основания, например: CrO → Cr(OH)2 MnO → Mn(OH)2 Зато в высших степенях они проявляют уже свойства неметаллов, образуя кислотные оксиды и соотвествующие кислоты, например: СrO3 → H2CrO4 (хромовая кислота) Mn2O7 → HMnO4 (марганцевая кислота)
А в промежуточных степенях окисления образуют амфотерные оксиды и гидроксиды, например, Cr2O3 и Cr(OH)3, которые взаимодействуют как с кислотами: Сr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O 2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2О так и со щелочами: Сr2O3 + 2NaOH + 3Н2О = 2Na[Сr(OH)4] Cr(OH)3 + NaOH = ¶Na[Cr(OH)4] Химическая активность металлов определяется их положением в Периодической системе химических элементов. Так, в периодах (горизонтальных рядах) атомные радиусы уменьшаются и, следовательно, способность отдавать электроны уменьшается, т.е. происходит ослабление химической активности при переходе, например от 11Na к 13Аl. А в главных подгруппах I и II групп атомные радиусы возрастают при переходе сверху вниз и, стало быть, возрастает способность отдавать валентные электроны и, соответственно, возрастает химическая активность в вертикальных рядах 3Li - 55Cs и 4Be – 56Ba. Кроме этого, химическая активность металлов определяется их положением в ряду напряжений металлов (другие названия – вытеснительный ряд, электрохимический ряд напряжений): Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Cd, Fe, Sn, Pb, H, Cu, Hg, Ag, Pt, Au В этот ряд помещён водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот: металлы, стоящие в этом ряду до водорода, вытесняют его (водород) из растворов кислот (кроме азотной HNO3), а стоящие после водорода не могут его вытеснять. Наиболее активные металлы, щелочные и щелочноземельные, вытесняют водород не только из растворов кислот (кроме HNO3), но и из воды и спиртов: 2Na + 2H2O = 2NaOH + H2↑ Ca + 2C2H5OH = (C2H5OH)2Ca + H2↑ Такие металлы, как Al Mn Zn, не вытесняют водород из воды, так как на поверхности этих металлов образуются защитные плёнки из оксидов и гидроксидов. Зато амальгамированный алюминий (сплав со ртутью), на котором не образуется плотный слой Al2O3, энергично реагирует с водой: 2Аl + 6H2O = 2Al(OH)3 + 3H2↑ 8.3 Отношение металлов к разбавленным растворам кислот. Уже было отмечено, что металлы, стоящие в ряду активности до водорода, вытесняют его из растворов кислот (кроме HNO3). В ряде случаев при взаимодействии металлов образуются нерастворимые или малорастворимые продукты, тормозящие дальнейшее окисление. Например, свинец не растворяется в разбавленных кислотах – серной и соляной,- так как при взаимодействии с ними образуются нерастворимые осадки (PbSO4 и PbCl2), предохраняющие его от дальнейшего окисления. Нерастворимые продукты чаще всего образуются при взаимодействии металлов с фосфорной кислотой. На этом основан метод фосфатации кузовов легковых автомобилей с целью их защиты от коррозии. Отштампованные кузова погружают в 30%-ный раствор ортофосфорной кислоты, в результате реакции образуется плотный слой нерастворимого фосфата Fe2(PO4)3. После этой операции следуют грунтовка и покраска кузова.
Интересно отношение алюминия к кислотам. Если разбавленные соляная и серная кислоты легко растворяют алюминий, например: Al + 6HCl = 2AlCl3 + 3H2 ↑ то как сильно разбавленная, так и концентрированная азотная кислота не взаимодействуют с металлическим алюминием. Было уже отмечено, что благородные металлы – золото Au, платина Pt и платиновые металлы (Ir, Os, Pd, Rh, Ru) растворяютя в царской водке (смесь 3 объёмов концентрированной HCl и 1 объёма концентрированной HNO3), например: 3Pt + 18HCl + 4HNO3 = 3H2PtCl6 + 4NO↑ + 8H2O Однако есть два металла платиновой группы, родий Rh и иридий Ir, на которые не действует даже царская водка. 8.4 Амфотерные металлы. Некоторые металлы проявляют амфотерные свойства (amphoteros – и тот, и другой) – растворяются как в кислотах, так и в щелочах. Вот как это происходит, например, в случае алюминия и цинка с образованием соответствующих комплексных гидроксидов: 2Al + 2NaOH + 6H2O = 2Na[Al(ОH)4] + 3H2↑ Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑ Из-за такого «плохого» поведения алюминия Всемирная организация здравоохранения уже давно не рекомендует его использовать для изготовления кухонной посуды (ионы Al+3 провоциируют развитие болезни Альцгеймера). 8.5 Жесткость воды. Природные воды почти всегда содержат растворенные соли щелочноземельных металлов кальция и магния, так называемые «соли жесткости». Вода с большим содержанием «солей жесткости» называется жесткой, а с малым содержанием – мягкой. Жесткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жесткой воды вызывает образования осадка (накипи) на стенках котлов, в трубах и др. Жесткость природных вод может варьироваться в довольно широких пределах и в течение года она непостоянна. Увеличивается жесткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда. Для численного выражения жесткости воды указывают в ней концентрацию катионов кальция и магния. В системе единиц СИ рекомендуется выражать концентрацию в моль на кубический метр (моль/м3).Однако на практике для измерения жесткости по-прежнему используются градусы жесткости в европейских странах и в США, а в нашей стране – миллиграммы эквивалентов кальция и магния на литр (мг-экв/л).Один мг-экв/л соответствует содержанию в литре воды 20,04 мг Са2+ или 12,16 мг Мg2+ (эквивалентная масса равна молярной массе, деленной на валентность элемента).
Общей жесткостью воды называется суммарное содержание ионов кальция и магния в литре воды (Са2+ + Мg2+) ммоль экв/л, или (Са2+ + Мg+2) = 32,2 мг/л. В нашей стране общая жесткость питьевой воды не должна быть более 7 ммоль экв/л (не более 225,2 мг/л. Различают карбонатную и некарбонатную жесткость. Первая обусловлена присутствием растворимых гидрокарбонатов Ca(HCO3)2 и Mg(HCO3)2, вторая – присутствием хлоридов и сульфатов кальция и магния CaSO4 и МgSO4. Карбонатную жесткость называют ещё временной жесткостью, т.к. она устраняется длительным кипячением. При этом гидрокарбонаты переходят в нерастворимые осадки: Ca(HCO3)2 → CaCO3↓ + H2O + CO2↑ Mg(HCO3)2 → Mg(OH)2↓ + CO2↑ Во втором случае образуется Mg(OH)2, т.к. он менее растворим, чем MgCO3. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью, которую устраняют путём добавления кальцинированной соды Na2CO3 или ортофосфата натрия Na3PO4, при этом ионы кальция и магния переходят в осадок: 3СаСl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl 3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4 Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием 8.6 Коррозия металлов и защита от неё. Основным недостатком «главного» металла нашего века – железа – является его способность подвергается коррозии, т.е. разрушению в атмосферных условиях. Изделия из всех видов сталей (кроме специальных нержавеющих) подвергаются ржавлению. Как это происходит? Как правило, металлы и их сплавы неоднородны, содержат включения различных примесей. При контакте с влажным воздухом, т.е. с электролитом, одни участки поверхности изделия будут выполнять роль анода (отдавать электроны), а другие – роль катода (принимать электроны). Рассмотрим пример, когда в качестве примеси будет выступать медь. При контакте с электролитом на железе как более активном металле будут протекать процессы окисления и перехода его катионов в электролит: Feo – 2e– = Fe2+ (анод) Поток электронов будет перемещаться к меди, менее активному металлу. Медь будет выполнять роль катода. В зависимости от создавшейся среды (кислотной или нейтральной) на катоде могут протекать разные процессы. В одном случае будет наблюдаться выделение водорода Н2 (среда кислотная): 2Н+ +2е– → Н2↑ в другом – образование ржавчины (среда нейтральная), состоящей в основном из Fe2O3∙nH2O. Если среда нейтральная, на катоде будет идти процесс восстановления кислорода: O2 + 2H2O + 4e– → 4OH– Образовавшиеся ионы будут давать гидроксид железа(II): Fe2+ + 2e– → Fe(OH)2 А гидроксид железа (II) в присутствии воды и кислорода будет переходить в гидроксид железа(III), т.е. в ржавчину: 4Fe(OH)2 + O2 +2H2O → 4Fe(OH)3 Способы защиты от коррозии. Цель – защитить (изолировать) изделие от влаги водуха и кислорода. 1) Нанесение защитных покрытий (краски, лак, эмали); 2) Нанесение защитных покрытий из других металлов: лужение, цинкование, никелирование, хромирование; 3) Приклепывание, например, к подводной части стального корпуса судна пластинок из цинка, которые будут играть роль анода и растворяться, защищая стальной корпус. 4) Фосфатирование – создание плотного защитного слоя фосфата железа Fe2(PO4)3, и другие способы защиты стальных изделий от коррозии.
Драгоценные металлы. В заключение остановимся на пробности драгоценных металлов – золота, пла-тины и серебра. В разных странах существуют разные виды пробности: метричес-кая проба – число единиц массы драгоценного металла в 1000 единицах сплава; каратная проба – число единиц массы в 24 каратах сплава; золотниковая проба – число единиц массы в 96 долях сплава (в России до 1927 года была золотниковая система). Итак, чистый драгоценный металл – это проба 1000о – 24 кар – 96 долей 958о – 23 кар – 92 доли 916о – 22кар – 88 долей 750о – 18кар – 72 доли 585о – 14 кар – 56 долей 375о – 9 кар – не было В России для платины существуют пробы 950о, 900о, 850о; для серебра 925о и 875о. Отметим, что 1 золотник = 4,266 г = 96 долям; 1 фунт аптекарский = 409,5 г; 1 унция монетная = 31,1035 г; 1 карат = 0,2 г. Вопросы и задачи по теме «Металлы».
1. Какие металлы из приведенных ниже реагируют с водой при комнатной температуре: Zn, Mg, Ca, Fe, Al, Na, K, Pb, Cu? 2. Какие металлы растворяются в водном растворе NaOH: Ca, Fe, Be, Mg, Al, Zn, Sn, K, Li? 3. Какие металлы не взаимодействуют с концентрированной H2SO4: Mg, Zn, Al, Cu, Fe, Ag, Cr, Au, Ca? 4. Что произойдёт, если в раствор соли свинца, например Pb(NO3)2, после- довательно погрузить пластинки из Cu, Ag, Zn, Mg, Al, Au, Mn, Ni? 5. Какие металлы растворяются в царской водке: Os, Pd, Pt, Ir, Au, Ru? 6. На какие из приведенных металлов действует концентрированная HNO3 Al, Mg, Zn, Ag, Au, Cu, Hg, Fe? 7. Какие оксиды из приведенных ниже будут растворяться в растворе KOH: ZnO, FeO, Cr2O3, NiO, SnO, MgO, CaO, Al2O3? 8. Известный факт – магний при обычной температуре не взаимодейству- ет с водой, но как только в воду бросить несколько кристалликов NH4Сl, начинается бурная реакция с выделением водорода. Как объяснить подобное явление? Справочный материал
Концентрация вещества в растворе. m(г) – масса растворенного вещества; W(г) – масса растворителя, R(г) – масса раствора. (R = m + W); ρ (г/мл) – плотность раствора; δ – массовая доля; V(л) – объем раствора; R = ρ×V масса раствора m = ρ×V×δ масса растворенного вещества; n(моль) = m/M – количество вещества. Процентная концентрация, 40% раствор (в 100 г раствора, 40г растворенного вещества + 60г растворителя) Массовая доля вещества в растворе Массовая доля элемента в веществе: m – масса вещества. Задача: вычислить массовую долю железа в 464 г Fe3O4 Решение: в 1 моле Fe3O4 3 моля железа Fe. 464г это 464/232 = 2 моля Fe3O4, след., масса элемента (Fe) m(э) = 2×3×56 г = 336 г δ(э)=336/464 = 0,72. Молярная конц. CM = V(л) – объем раствора. m(г) = СМ×M×V; m = ρ×V×δ; Моляльная конц. Cm = W(г) = масса растворителя. W = R – m W = ρV – ρVδ = ρV(1 – δ); Нормальная конц. СH = k(соли) = число атомов металла ×валентность металла; k[Al2(SO4)3] = 2×3 = 6 k(кислоты) равно числу атомов водорода в составе кислоты; k[H3PO4] = 3 k(гидроокисла) равно числу гидроксильных групп [OH─]; k[Ca(OH)2] = 2 Кристаллогидраты: масса кристаллогидрата m(kr) = m(соли)× масса соли в кристаллогидрате m(соли) = m(kr)×
Таблица. Основные физическо − химические константы
Растворимость кислот, оснований и солей в воде. Ряд активности металлов.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 83; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.230.44 (0.101 с.) |
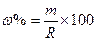 R = ρ×V; m = ρ×V×δ
R = ρ×V; m = ρ×V×δ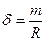 ; R = ρ×V; m = ρ×V×δ
; R = ρ×V; m = ρ×V×δ m(э) – масса элемента
m(э) – масса элемента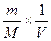 m(г) – масса растворенного вещества
m(г) – масса растворенного вещества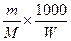 Cm =
Cm = 
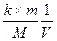 k – коэф. эквивалентности. СН = k×CM
k – коэф. эквивалентности. СН = k×CM