Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Инструментальная диагностикаСодержание книги
Поиск на нашем сайте Рекомендация 5. У пациента с ОРДС рекомендовано про- анализировать характер изменений на рентгенограмме (диф- фузные, очаговые, сливные) с целью дифференциальной ди- агностики — для ОРДС характерно наличие двусторонних диффузных инфильтратов, а при доступности метода и транс- портабельности пациента рекомендовано провести компьютер- ную томографию легких для определения степени негомоген- ности повреждения легких и наличия участков консолидации и «матового стекла» для оценки ведущего патогенетическо- го механизма и потенциала рекрутабельности альвеол (уро- вень достоверности доказательств 3, уровень убедительно- сти рекомендаций В). Комментарий: Для ОРДС характерно диффузное аль- веолярное повреждение (ДАП), что отражается в виде диф- фузных затемнений на фронтальной рентгенограмме лег- ких и появлению диффузных затемнений по типу матового стекла и/или консолидации на КТ легких. Чувствительность рентгенографии грудной клетки при ОРДС при наличии билатеральных инфильтратов (один из ведущих критериев) составляет примерно 75%, а специфичность 70%, что при- водит к высокой частоте ложноположительных и ложно- отрицательных результатов при применении этого метода в диагностике ОРДС [14, 43]. Наличие только очаговых из- менений свидетельствует против ОРДС. Наличие диффуз- ных инфильтратов на фронтальной рентгенограмме может быть следствием не только ОРДС, но и ателектазирования дорсальных отделов легких, двусторонней полисегментар- ной пневмонии, отека легких, их сочетания, а также других специфических заболеваний легких [44, 45]. Компьютерная томография в отличие от рентгеногра- фии позволяет проводить дифференциальную диагности- ку ОРДС от пневмонии и других причин гипоксемической ОДН и диагностику стадий ОРДС [44, 46]. В ранних стадиях ОРДС особенно выражена негомо- генность поражения. Кроме того, имеется градиент плот- ности, направленный от верхушек легких к их базальным отделам. По данным компьютерной томографии при ОРДС в ранней стадии существуют 4 зоны: — зона здоровых альвеол (вентилируемые зоны); — зона рекрутирования «нестабильных» альвеол; — зона коллапса альвеол; — зона перераздувания альвеол. Изменения по типу матового стекла связаны с утол- щением межальвеолярных перегородок, отеком интерсти- ция легких, коллапсом альвеол, в то время как «консоли- дация» легочной ткани является результатом накопления жидкости в просвете альвеол. «Матовое стекло» более ха- рактерно для так называемого вторичного (внелегочного) ОРДС, возникающего чаще всего при внелегочном сеп- сисе, тяжелой неторакальной травме, после длительного искусственного кровообращения, после массивной кро- вопотери [7, 47, 48]. Оба эти рентгенологических феномена (матовое стек- ло и консолидация) могут зачастую присутствовать у од- ного пациента одновременно, поэтому для оценки потен- циального эффекта от применения ИВЛ и риска развития острого легочного сердца необходимо выделить преобла- дающий компонент [49]. Патогенез ОРДС (легочный, вне- легочный) значимо влияет на картину томограммы [50, 51]. У пациентов с легочным ОРДС томографическая картина имеет участки локальных асимметричных сочетаний за- темнений легочной ткани по типу «матового стекла» и кон- солидации, в то время как при внелегочном ОРДС карти- на симметрична, затемнения носят диффузный характер, причем в верхних участках легких они имеют характер за- темнения по типу «матового стекла», а в нижних — консо- лидации легочной ткани [52]. В поздних стадиях синдрома развивающийся фиброз вызывает нарушения формы интерстициальных и бронхо- васкулярных теней, картина поражения легких становит- ся более гомогенной, может увеличиваться число и объем субплевральных кист. У пациентов, перенесших ОРДС, КТ картина имеет выраженную «сетчатость», тем более выра- женную, чем длительнее и «агрессивнее» была ИВЛ [53— 55]. Ретикулярные изменения — признак фиброза — силь- нее выражены в вышележащих, лучше вентилируемых при ИВЛ участках легких. Рекомендация 6. Всем пациентам с предполагаемым или подтвержденным ОРДС рекомендовано мониторировать насы- щение гемоглобина кислородом при помощи пульсоксиметра (SpO 2) для оценки степени гипоксемии (уровень достоверно- сти доказательств 3, уровень убедительности рекомендаций В) Комментарий: В соответствии с кривой диссоциации оксигемоглобина, снижение SpO2 ниже 90% соответствует снижению PaO2 ниже 60 мм рт.ст. [56]. При наличии дру- гих критериев ОРДС (острое начало ОДН с известной при- чиной, билатеральные диффузные инфильтраты на рент- генограмме) диагноз ОРДС вероятен. Рекомендация 7. У пациентов с ОРДС рекомендовано оце- нить примерное соотношение парциального давления кисло- рода в артериальной крови к инспираторной фракции кисло- рода (PaO2/FiO2) при помощи пульсоксиметрии и рассчитать коэффициент SpO2/FiO2) для оценки степени тяжести ОРДС (уровень достоверности доказательств 3, уровень убедитель- ности рекомендаций В) Комментарий: Кривая диссоциации оксигемоглобина характеризуется жестким соответствием между SaO2 и PaO2 при SpO2 менее 97% [56, 57] — величине SpO2 90% пример- но соответствует PaO2 60 мм рт.ст., величине SpO2 80% при- мерно соответствует PaO2 40 мм рт.ст (с поправкой на рН и рСО2). Соответственно, при снижении SpO2 при дыхании атмосферным воздухом менее 90% индекс PaO2/FiO2 бу- дет ниже 300 мм рт.ст., а при снижении SpO2 менее 80% — менее 200 мм рт.ст. Тест ориентировочной исходной оценки индекса PaO2/FiO2 по SpO2 у пациентов с самостоятельным дыха- нием рекомендуется для повседневной практики с соблю- дением обязательного условия — дыхание пациента воз- духом без добавки кислорода в течение нескольких минут. Обсервационное исследование у пациентов с ОРДС (n =672, 2673 измерения и 2031 проверочное измерение) продемонстрировало, что взаимосвязь между SpO2/FiO2 и PaO2/FiO2 можно описать следующим уравнением: SpO /FiO =64+0,84·(PaO /FiO) 4. Отсутствие признаков левожелудочковой недостаточ- ности или ДЗЛК менее 18 мм рт.ст. В критериях AECC под ОРДС было предложено пони- мать ОПЛ, при котором индекс PaO2/FiO2 равен или ни- же 200. Согласительная конференция экспертов по ОРДС в Берлине, проведенная в 2011 г., приняла новое междуна- родное определение ОРДС («Берлинское определение») [28]. В этом определении во избежание путаницы было решено отказаться от термина ОПЛ, а ОРДС разделить на 3 степе- ни тяжести в зависимости от индекса PaO2/FiO2 (см. табл. 2). В 2013 г. точность Берлинских критериев ОРДС была оценена на аутопсии умерших за период 1991—2010 гг. па- циентов ОРИТ, за ОРДС на аутопсии принимали призна- ки ДАП. Пациентов с клиническими критериями ОРДС по данным медицинских карт стратифицировали на ОРДС легкой, средней и тяжелой степени в соответствии с Бер- линскими критериями ОРДС. Микроскопия каждой до- ли обоих легких была выполнена двумя патоморфолога- ми. Среди 712 аутопсий 356 пациентов имели признаки ОРДС на момент смерти (легкий — 14%, среднетяжелый 40% и тяжелый — 46%). Берлинские критерии ОРДС про- 2 2 2 2 демонстрировали чувствительность 89% и специфичность (p <0,0001; r =0,89). Величина SpO2/FiO2 235 соответству- ет PaO2/FiO2 200 (чувствительность 85%, специфичность 85%), а SpO2/FiO2 315 соответствует PaO2/FiO2 300 (чув- ствительность 91%, специфичность 56%) [58]. Рекомендация 8. У пациентов с ОРДС рекомендовано ис- пользовать Берлинское определение ОРДС для диагностики и оценки степени его тяжести (таблица 2) (уровень достоверно- сти доказательств 3, уровень убедительности рекомендаций В). Комментарий: Патоморфологически ОРДС соответству- ет диффузному альвеолярному повреждению. Впервые тер- мин ОРДС был введен в 1967 г. Ashbaugh и соавт. [59]. Первые критерии включали: фактор риска, тяжелую гипоксемию, ре- зистентную к ингаляции кислорода, двусторонние инфиль- траты на рентгенограмме, сниженную податливость респира- торной системы и отсутствие признаков застойной сердечной недостаточности. В 1988 г. J. Murray и соавт. разработали шка- лу повреждения легких (LIS), которая дополнительно вклю- чала уровень РЕЕР, но исключала упоминание о сердечной недостаточности (табл. 3) [60]. Предыдущее (до Берлинского) определение ОРДС было дано в 1992 г. Согласительной кон- ференцией американских и европейских экспертов (American- European Consensus Conference — AECC), которая предложи- ла термины ОПЛ (Acute Lung Injury — ALI) и ОРДС [61]. Ди- агноз ОПЛ основан на следующих критериях: 1. Острое начало. 2. Двусторонние инфильтраты на рентгенограмме орга- нов грудной клетки. 3. Снижение индекса PaO2/FiO2 менее 300 мм рт.ст. 63% для выявления ДАП. ДАП было найдено у 45% паци- ентов с Берлинскими критериями ОРДС (у 12, 40 и 58% па- циентов с легким, среднетяжелым и тяжелым ОРДС соот- ветственно). ДАП находили чаще у пациентов с критерия- ми ОРДС, сохранявшимися в течение более 72 часов, в том числе и у 69% пациентов с критериями тяжелого ОРДС [62] В ретроспективном обсервационном исследовании биопсии легких у пациентов с пролонгированным ОРДС ДАП был найден у 36% пациентов с легким, у 59% пациен- тов со среднетяжелым и у 69% пациентов с тяжелым ОРДС (чувствительность Берлинских критериев составила 58%, а специфичность 73%) [63]. Другие физиологические показатели также имеют обоснование для вхождения в диагностические критерии ОРДС — податливость респираторной системы, внесосу- дистая вода легких, альвеолярное мертвое пространство, ультразвуковые критерии и т.д., однако они в своем боль- шинстве неприменимы в практике каждой клиники. По- датливость респираторной системы (удаленная из критери- ев в 1992 г.) доступна для измерения, хорошо прогнозирует летальный исход и при включении в диагностические кри- терии (шкала LIS, метод Delphi)[60,64] прогнозирует ДАП гораздо лучше, чем только критерии АЕСС [36]. Рекомендация 9. Для оценки негомогенности поврежде- ния легких и степени тяжести ОРДС у пациентов, которым проводят ИВЛ, рекомендовано рассчитать статическую по- датливость респираторной системы (Cstat) как отношение дыхательного объема (Vt) к разнице между давлением пла-
Острое начало: появление или нарастание степени острой дыхательной недостаточности в течение 1 недели по известной клинической причине или появление новых причин
Рентгенография Билатеральные инфильтраты на фронтальной рентгенограмме органов грудной клетки Причина отека Дыхательная недостаточность не полностью объясняется сердечной недостаточностью или перегрузкой жидкостью. Необходима объективная оценка (например, эхокардиография), чтобы исключить гидро- статический отек, если нет факторов риска Оксигенация Легкий 200 мм рт.ст. < PaO2/FiO2 ≤300 мм рт.ст. при PEEP или CPAP ≥5 см H2O Среднетяжелый 100 мм рт.ст. < PaO2/FiO2 ≤200 мм рт.ст. при PEEP ≥5 см H2O Тяжелый PaO2/FiO2 ≤100 мм рт.ст. при PEEP ≥5 см H2O
то (Pplat, давление во время инспираторной паузы) и конеч- но-экспираторным давлением: Cstat=Vt/(Pplat-PEEP) (уро- вень достоверности доказательств 2, уровень убедительно- сти рекомендаций В). Комментарий: Расчет статической податливости ре- спираторной системы имеет значение для оценки степе- ни тяжести ОРДС по шкале LIS (табл. 3), оценки диффуз- ного или локального повреждения легких (при локальном повреждении легких податливость снижена незначитель- но), оценки степени нарушения податливости грудной стенки и оценки потенциальной рекрутабельности альве- ол при увеличении давления в дыхательных путях (рекру- тировании альвеол или настройке РЕЕР) [19, 37, 54, 65, 66]. Сниженная податливость свидетельствует о диффуз- ном повреждении легочной ткани и/или снижении по- датливости грудной стенки. Увеличение исходно снижен- ной податливости при увеличении РЕЕР и/или рекрути- ровании альвеол соответствует высокой рекрутабельности альвеол и ассоциирована с более благоприятным исхо- дом ОРДС [66]. Рекомендация 10. У пациентов с ОРДС, которым про- водят ИВЛ, рекомендовано использовать шкалу поврежде- ния легких (Lung Injury Score — LIS), так как она может бо- лее точно охарактеризовать степень повреждения легких при ОРДС, чем Берлинское определение ОРДС (табл. 3) (уро- вень достоверности доказательств 3, уровень убедительно- сти рекомендаций В) Комментарий: Шкала LIS прогнозирует ДАП гораздо лучше, чем критерии АЕСС [36]. При сравнительной оцен- ке шкалы LIS, критериев AECC было установлено, что обе шкалы имеют схожую диагностическую ценность у пациен- тов высокой степени риска — более 90% [67]. Диагноз ОРДС был достоверен при оценке по шкале LIS более 2,5 баллов. Рекомендация 11. Пациентам с ОРДС при проведении ИВЛ рекомендовано использовать возможный дополнитель- ный мониторинг для оценки рекрутабельности альвеол и оп- тимизации параметров респираторной поддержки (при до- ступности методов): статическую петлю «давление—объем», пищеводное (и, соответственно, транспульмональное) дав- ление, конечно-экспираторный объем легких (EELV — end- expiratory lung volume), внесосудистую воду легких (EVLW — extravascular lung water) (уровень достоверности доказательств 3, уровень убедительности рекомендаций В). Комментарий: Методы оценки состояния механики респираторной системы, внесосудистой воды легких и ле- гочных объемов позволяют более точно охарактеризовать основные факторы, способствующие коллапсу альвеол, препятствующих открытию коллабированных альвеол и па- тофизиологический механизм повреждения альвеол [37, 50, 68—73]. Статическая петля «давление—объем» позволяет вы- делить пациентов с диффузным альвеолярным поврежде- нием — значение точки нижнего перегиба выше 10 мбар свидетельствует о диффузном повреждении альвеол, а ме- нее 10 — локальное повреждение, нерекрутабельные лег- кие [19, 37, 74]. Мониторинг пищеводного (Pes) и транспульмонально- го давления (Ptp) позволяет оценить вклад внешнего дав- ления на альвеолы, возникающего вследствие сдавления нижележащей легочной ткани вышележащими отделами легких, органами средостения (сердце, клетчатка средо- стения), органами брюшной полости и забрюшинного про- странства, а также повышенного плеврального давления, например, при ожирении [19, 20, 75, 76]. Кроме того, мо- ниторинг пищеводного давления позволяет выделить от- дельно податливость легких (CL) и податливость грудной стенки, что позволяет оценить рекрутабельность альвеол, а соответственно и тактику респираторной терапии (CCW) [77—79]: CL=Vt/∆Ptp; CCW=Vt/∆Pes. Мультицентровое РКИ EpVent-2, сравнившее настрой- ку РЕЕР по нулевому транспульмональному давлению на выдохе с РЕЕР на основе таблицы PEEP/FiO2 исследова- ния ALVEOLI продемонстрировало почти полную их иден- тичность по результирующим величинам РЕЕР [80] у боль- шинства пациентов. Функциональная остаточная емкость — это объем га- за, который остается в легких в конце спокойного выдоха, при этом респираторная система находится в точке эла- стического равновесия, а давление в альвеолах (при само- стоятельном дыхании) равно нулю, альвеолы при этом от- крыты. При проведении ИВЛ с PEEP мы можем измерить не ФОЕ, а конечно-экспираторный объем легких (EELV, End-Expiratory Lung Volume) при каждом уровне PEEP. РЕЕР нужен только тем пациентам, у которых его увели- чение приводит к увеличению EELV больше ожидаемого (открытие альвеол). Показано, что при отсутствии рекру- тирования (раскрытия) альвеол с повышением РЕЕР про- исходит прирост EELV, пропорциональный податливости респираторной системы (∆EELV=∆PEEP·Crs)[189]. Уве- личение EELV, превышающее расчетную величину, сви- детельствует о раскрытии альвеол с повышением РЕЕР. Разница между расчетным и реальным ∆EELV является
Таблица 3. Шкала повреждения легких (Lung Injury Score — LIS)* [60]
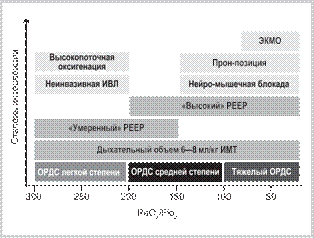
*Общую сумму баллов делят на 4 количественной мерой рекрутированных альвеол. Можно допустить, что РЕЕР нужен тем пациентам, у которых его увеличение приводит к увеличению EELV больше ожида- емого (открытие альвеол). При первичном ОРДС (например, при гриппе), по- видимому, прямое измерение EELV более значимо, чем из- мерение транспульмонального давления, так как податли- вость грудной стенки может быть не нарушена, а рекрута- бельность альвеол у разных пациентов может различаться ввиду различных морфологических изменений в легких (кол- лапс альвеол или заполнение альвеол экссудатом, «матовое стекло» или «консолидация» на КТ легких). Теоретически рассчитать изменение конечно-экспираторного объема лег- ких при увеличении PEEP возможно, исходя из следующей формулы [81—83]: ∆EELV=∆PEEP·CL, где CL=Vt/∆Ptp. Однако при таком подходе мы сталкиваемся с ошиб- ками в связи с допущениями, что кривая податливости на- чинается от нуля (что не соответствует физиологии дыха- ния) и что пищеводное давление соответствует плевраль- ному в каждом участке плевральной полости (что также не соответствует действительности). Мониторинг внесосудистой воды легких также позво- ляет оценить стратегию лечения пациента с ОРДС — уве- личение ВСВЛ более 12 мл/кг ассоциировано с более низ- кой рекрутабельностью альвеол (альвеолы заполнены жид- костью, «консолидация») и худшим прогнозом [70, 71, 84]. Применение рестриктивной стратегии инфузионной те- рапии, диуретической терапии и ультрафильтрации мо- жет иметь значимое влияние на прогноз у этих пациентов [70, 71, 85—87]. Иная диагностика Рекомендация 12. У пациентов с предполагаемым ОРДС рекомендовано измерить внутрибрюшное давление с использо- ванием катетера мочевого пузыря для оценки вклада внутри- брюшного давления в коллапс альвеол (уровень достоверности доказательств 3, уровень убедительности рекомендаций В). Комментарий: При развитии синдрома интраабдо- минальной гипертензии (внутрибрюшное давление вы- ше 15 мм рт.ст.) увеличивается жесткость грудной стенки, что приводит к коллапсу альвеол [14–16]. На сегодняшний день наиболее точным методом для оценки внутрибрюш- ного давления считают измерение давления в полости мо- чевого пузыря при введении через катетер в полость моче- вого пузыря 25 мл теплого стерильного раствора, принимая за ноль лонное сочленение. Увеличение давления в моче- вом пузыре выше 20 мбар свидетельствует об интраабдоми- нальной гипертензии, которая приводит к дополнительно- му коллабированию альвеол [14—16]. Рекомендация 13. У пациента с ОРДС рекомендовано из- мерить рост, массу тела и рассчитать индекс массы тела для оценки вклада индекса массы тела в коллабирование альвеол и выбора оптимального РЕЕР (уровень достоверности доказа- тельств 3, уровень убедительности рекомендаций В). Комментарий: Избыточная масса тела вносит свой вклад в коллапс альвеол при ОРДС — чем выше индекс массы тела, тем выше плевральное давление и давление на альвеолу снаружи (ниже транспульмональное давле- ние) и тем больше подвержены коллапсу альвеолы, распо- ложенные в дорсальных и нижнебазальных отделах легких [18—20, 83, 88, 89]. Лечение Интенсивная терапия ОРДС Рекомендация 14. При интенсивной терапии пациентов с ОРДС рекомендовано использовать дифференцированный подход в зависимости от причин возникновения, сроков по- сле начала и ведущих патогенетических механизмов для вы- бора оптимальной тактики интенсивной терапии (уровень до- стоверности доказательств 3, уровень убедительности реко- мендаций С). Комментарий: Основное заболевание, причина ОРДС, тип ОРДС (прямой или непрямой), патоморфологические особенности при ОРДС обуславливает разное клиническое течение ОРДС, различный ответ на проводимую терапию, в том числе респираторную поддержку и рекрутирование альвеол и различные исходы [6, 24, 90]. Принципы интенсивной терапии во многом зависят от причины, патогенетического механизма и тяжести ОРДС и должны преследовать следующие цели [6, 90]: — ликвидация заболевания, вызвавшего развитие ОРДС (проведение оперативного вмешательства, хирургиче- ская санация очага инфекции, лечение шока и т.п.); — коррекция и поддержание приемлемого газообмена (оксигенотерапия, включая высокопоточную оксиге- нацию, неинвазивная и инвазивная ИВЛ, экстракор- поральные методы обеспечения газообмена) [91—94]; — улучшение легочного кровотока [95—97]; — коррекция гемодинамических нарушений (инфузи- онная терапия, инотропные и вазоактивные препа- раты) [98, 99]; — дегидратация легких (диуретики, ограничение инфу- зии, заместительная почечная терапия) [71, 84, 86, 100]; — недопущение или снижение вентилятор-ассоцииро- ванного повреждения легких [91, 101, 102]; — обеспечение организма макро- и микронутриентами [103, 104]. Подробное описание принципов дифференцирован- ного подхода и соответствующих терапевтических меро- приятий изложено ниже. Респираторная терапия Рекомендация 15. У пациентов с ОРДС рекомендова- но использовать пошаговый подход в выборе методов респи- раторной терапии для улучшения результатов лечения: при ОРДС легкой степени возможно использование высокопоточ- ной оксигенации (ВПО) и неинвазивной ИВЛ (НИВЛ), при ОРДС средней и тяжелой степени показана интубация трахеи и инвазивная ИВЛ (схема 1) (уровень достоверности доказа- тельств 1—2, уровень убедительности рекомендаций A—B). Комментарий: Респираторная поддержка в различных режимах является методом временного протезирования функции внешнего дыхания, обеспечивает поддержание газообмена в легких, снижает работу дыхания и предостав- ляет время для восстановления функций легких. У некото- рых пациентов с ОРДС возможно поддерживать адекватный газообмен в легких при спонтанном дыхании с ингаляцией кислорода и положительным конечно-экспираторным дав- лением, либо посредством использования различных неин- вазивных методов респираторной поддержки. Однако дан- ные мультицентровых когортных исследований показыва- ют, что большинство больных с ОРДС (до 85%) нуждаются в инвазивной вспомогательной или полностью управляе- мой искусственной вентиляции легких [105,106].
Схема. Степень интервенции в зависимости от тяжести ОРДС. На основании мультицентровых РКИ консенсусом экспертов была сформирована схема пошагового подхода к терапии ОРДС — [28, 66, 91, 106—110]. Рекомендация 16. Пациентам с ОРДС рекомендовано ин- тубировать трахею и начинать инвазивную ИВЛ по следующим абсолютным показаниям: апноэ, остановка кровообращения, нарушения сознания (возбуждение, делирий, оглушение, со- пор, кома), нарушение глоточных рефлексов, кашлевого толч- ка, парез голосовых складок (уровень достоверности доказа- тельств 5, уровень убедительности рекомендаций С). Комментарий: С позиции физиологии и здравого смыс- ла интубация трахеи необходима при полном отсутствии дыхания (апноэ, остановка кровообращения), также абсо- лютными показаниями к интубации трахеи является высо- кий риск аспирации (нарушения сознания, делирий) и на- рушения деятельности голосовых складок [5, 27, 56, 77]. РКИ по этическим соображениям по оценке абсолютных показаний для ИВЛ не проводили. У большинства пациентов с ОРДС абсолютные показа- ния к интубации трахеи (нарушение сознания, глоточных рефлексов, парез голосовых связок) возникают вследствие других причин — сепсис, травма, шок, полиорганная не- достаточность, полинейропатия критических состояний. Рекомендация 17. Подавляющее большинство пациентов с ОРДС нуждаются в интубации трахеи и инвазивной ИВЛ (абсолютные и относительные показания), так как это при- водит к улучшению исхода (уровень достоверности доказа- тельств 3, уровень убедительности рекомендаций В). Комментарий: Изучение относительных показаний к респираторной поддержке по этическим соображени- ям в РКИ не изучали, эти показания разработаны консен- сусом экспертов в 1993 г. и с тех пор не претерпели изме- нений: участие вспомогательных дыхательных мышц, ча- стота дыхания более 35 в мин, сохраняющаяся гипоксемия (PaO2 менее 60 мм рт.ст. или SpO2 менее 90% несмотря на ингаляцию кислорода) и/или появившаяся гиперкапния, нестабильная гемодинамика [111]. В крупном мультицентровом когортном исследовании у 85% пациентов с ОРДС была интубирована трахея и на- чата ИВЛ, у большинства из них — в первые сутки [105]. PaO2/FiO2 у этих пациентов перед интубацией составил 146±84 мм рт.ст., у 74% был шок или необходимость в ка- техоламиновой поддержке, другие факторы имели мень- шую значимость [105]. В другом мультицентровом когортном исследовании у пациентов с ОРДС трахея была интубирована изначаль- но у 70% пациентов, оставшимся 30% пациентов проводи- ли неинвазивную ИВЛ, из которых у 46% пациентов НИВЛ была неэффективна, таким образом частота интубации тра- хеи в целом составила 84% [106]. Рекомендация 18. Перед интубацией и во время интуба- ции трахеи у пациентов с ОРДС рекомендовано использовать высокопоточную назальную оксигенацию для уменьшения степени и длительности гипоксемии (уровень достоверности доказательств 3, уровень убедительности рекомендаций С). Комментарий: Высокопоточная назальная оксигена- ция (в отличие от обычной кислородной маски или кисло- родных назальных канюль) обеспечивает поток кислорода до 60 л/мин, что приближено к величине пикового инспи- раторного потока пациента [77, 112], в отличие от стандарт- ной оксигенотерапии, обеспечивающей поток кислорода до 15 л/мин и инспираторную фракцию кислорода не вы- ше 35% [113]. В РКИ при интубации трахеи у пациентов с тяжелым и среднетяжелым ОРДС продемонстрировано отсутствие десатурации при использовании высокопоточной оксиге- нации перед и во время интубации трахеи по сравнению с лицевой маской с мешком, где SpO2 менее 80% отмечено у 14% пациентов [114]. В небольшом РКИ, сравнивающем ВПНО с венти- ляцией через маску и ручной мешок при интубации тра- хеи у пациентов с умеренной гипоксемией (PaO2/FiO2 пе- ред началом интубации около 200 мм рт.ст.), не отмечено различий по частоте десатурации во время интубации, од- нако при длительной интубации отмечено снижение SpO2 в группе ручного мешка [115]. Рекомендация 19. При наличии показаний у пациентов с ОРДС не рекомендовано задерживать интубацию трахеи и начало ИВЛ, так как отсрочка интубации трахеи при ОРДС ухудшает прогноз (уровень достоверности доказательств 2, уровень убедительности рекомендаций B). Комментарий: В крупном мультицентровом когорт- ном исследовании (n =457) поздняя интубация трахеи при ОРДС (2—4 сутки от диагностики ОРДС) приводила к уве- личению летальности с 36 до 56% [105]. Рекомендация 20. Пациентам с ОРДС при проведении респираторной терапии рекомендовано достигать следую- щих целевых значений артериальной оксигенации: PaO2 90— 105 мм рт.ст, SpO 2 95—98% (уровень достоверности доказа- тельств 2, уровень убедительности рекомендаций В), так как
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 138; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.017 с.) |