Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование миграционной активности нейтрофилов под агарозойСодержание книги
Поиск на нашем сайте
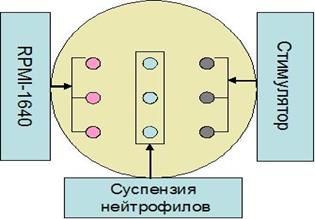
Оценка хемотаксиса лейкоцитов осуществляется двумя распространенными методами. Метод Бойдена основан на принципе прохождения лейкоцитов из одной половины камеры со взвесью клеток в другую половину с хемоатрактантом, разделенных между собой мембранным фильтром. С использованием камеры Бойдена возможно изучение эластичности клеток. Другой метод основан на хемотаксисе под слоем агарозы. Принцип этого метода состоит в способности клеток мигрировать в микропространстве между агарозой и поверхностью, на которую последняя нанесена.Движение клеток при отсутствии хемотаксического стимула дает характеристику случайной двигательной активности (спонтанная миграция) фагоцитов. В качестве хемоатрактанта используют обработанную зимозаном или липополисахаридом сыворотку, казеин, фильтрат культуры Е. coli или других микроорганизмов, синтетические формилпептиды. Оценка миграционной активности нейтрофилов имеет значение при наличии послеоперационных осложнений. Исследование выполняют следующим образом: 1. Готовят раствор агарозы в стерильной бидистиллированной воде в концентрации 2 мг/мл. Для этого агарозу добавляют в стерильную деионизированную воду (можно бидистилированную) в концентрации 2 мг/мл, кипятят на водяной бане при 100°С в течение 20 минут. 2. Раствор охлаждают до 50˚С и смешивают с двукратной полной культуральной средой, нагретой до 50˚С в соотношении 1:1. 3. В стерильные пластиковые чашки Петри заливают необходимый объем агарозы, так, чтобы толщина слоя составила 3 мм. 4. За час до проведения исследования с помощью пробойника в агарозе делают лунки диаметром 3 мм на расстоянии 3 мм друг от друга по 3 лунки в ряду и помещают в термостат (37˚С).
Рисунок 5.1 Исследования миграционной активности нейтрофилов под агарозой 5. В центральные лунки вносят по 10 мкл суспензии НФ в концентрации 107 кл/мл, в один столбец из боковых лунок – 10 мкл среды RPMI-1640, во второй столбец боковых лунок – 10 мкл стимулятора (например, fMLP - 10-5М) в соответствии с рисунком 5.1. 6. Чашки инкубируют при 37˚С в течение 90 минут. 7. После окончания инкубации в чашки заливают по 4 мл 10% раствора формалина и оставляют при комнатной температуре в течение 30 минут. 8. Формалин сливают и осторожно удаляют слой агарозы. 9. Чашки промывают бидистиллированной водой и высушивают на воздухе. 10. Окраску клеток можно проводить красителем Романовского-Гимзы. 11. Учет результатов проводят с использованием микроскопа с окуляром-микрометром. Измеряют длину пробега клеток по направлению к среде и длину пробега клеток к хемоаттрактанту. Вычисляют индекс миграции – отношение длины пробега клеток к хемоаттрактанту к длине пробега клеток к среде. Нормальные значения: индекс миграции к FMLP 2,6-2,8 к ИЛ-8 - 1,7-3. Оценка функциональной активности нейтрофилов на различных стадиях фагоцитоза in vitro методом оксиграфии (методика апробирована Лебедевой А.К., Вишневской Ю.А., МГЭУ им. А.Д. Сахарова, г. Минск, Беларусь, 2007г.) Эффективное протекание фагоцитарной реакции обеспечивается взаимодополняющим функционированием кислород-зависимых и кислород-независимых систем. При этом важная роль внешнего кислорода определяется в первую очередь его участием в процессе генерации активных кислородных радикалов, обладающих бактериоцидной активностью. В связи с эти потребление кислорода нейтрофилами, вступившими в фагоцитоз, увеличивается от 2 до 20 раз. Изменение содержания растворенного кислорода в среде в процессе фагоцитоза может быть определено методом окиграфии. Оксиграфия – это кинетический метод, в основе которого лежит постоянная регистрация изменения содержаний кислорода в среде в течение времени, что позволяет выявить нарушение различных этапов фагоцитоза разнесенных во времени: передачи активационного сигнала – генерацию активных форм кислорода – поглощение микроорганизма. Исследование проводят следующим образом: 1. Включить оксиграф. Ячейку оксиграфа заполнить дистиллированной водой и произвести калибровку прибора в соответствии с температурой воздуха и атмосферным давлением. Выставить нулевое значения путем добавления к дистиллированной воде дитионита натрия в концентрации 17,5 мМ,что позволяет полностью связать растворенный кислород. 2. Промыть ячейку оксиграфа дистиллированной водой и внести в нее 300 мкл культуры дрожжей в растворе Хенкса в концентрации 1×109 КОЕ/ мл. 3. Добавить к культуре дрожжей 300 мкл плазмы. Дождаться полной стабилизации уровня кислорода. 4. Внести в ячейку 300 мкл суспензии нейтрофилов в растворе Хенкса в концентрации 2,5 млн/мл. Мониторинг содержания кислорода проводят в течении 30 мин. Для линейного участка кривой поглощения рассчитывается скорость потребления кислорода, как отношение количества поглощенного кислорода ко времени, в течение которого это поглощение произошло. Степень завершенности фагоцитоза контролировали путем приготовления и последующего микрокопирования мазков инкубируемой суспензии. Новые возможности для выявления молекулярных механизмов дисфункций нейтрофилов методом оксиграфии появляются при создании дополнительной лекарственной нагрузки in vitro. Для этого могут быть использованы селективные блокаторы ионных каналов лидокаин и верапамил.
|
||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 186; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.61.199 (0.006 с.) |