Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Культуральный метод в комплексе иммунологических методов
Как известно, культуры клеток могут находиться в 2 основных видах - суспензионной (клетки не прикрепляются к стенкам или дну сосуда) и монослойной (клетки адгезируются к поверхности дна лабораторной посуды, образуя сплошной слой). Лимфоциты в большинстве случаев культивируют в виде суспензионной культуры. В иммунодиагностике культуральный метод применяют как для поддержания исследуемых лимфоцитов, так и для культивирования клеток-мишеней, необходимых для изучения, например, цитотоксической активности лимфоцитов. Такой подход часто требует различных условий для обеспечения культур клеток всем необходимым. Проведение культурального метода нуждается в специальном оборудовании и хорошо обученном персонале. Для поддержания жизнеспособности и функциональной активности клеток в искусственных условиях требуется соблюдение ряда правил: 1) поддержание стерильности среды. Осуществляется путем использования только стерильного инструментария, посуды, питательных сред и иных добавок. Все процедуры предварительной подготовки клеток к культивированию, мониторинга состояния культуры клеток в процессе исследования проводят в ламинарных боксах, обеспечивающих поток стерильного воздуха в зоне работы. В оборудовании для инкубации клеток также предусматривается подача стерильной газовой среды, либо полная изоляция ёмкостей с клетками от внешней среды. Дополнительно в питательную среду для культивирования клеток добавляют смесь противомикробных препаратов, включая антибиотики широкого спектра действия и антифунгицидные препараты. Дозы этих веществ рассчитывают, исходя из рекомендуемых терапевтических доз с учетом объема питательной среды (эти данные всегда можно уточнить в протоколах культивирования клеток),
2) обеспечение культивируемых клеток оптимальной газовой средой. В процессе метаболизма клетки нуждаются в присутствии 5 % СО2, уровень которого поддерживается специальным оборудованием: СО2-инкубатором, представляющим собой термостат со стационарно подведенной подачей смеси воздух: СО2. При необходимости клетки культивируют при постоянном перемешивании с помощью шейкера,
3) поддержание необходимого уровня осмотичности среды осуществляется использованием солевых растворов в качестве основы питательной среды. Сбалансированные солевые растворы (ССР) позволяют создать оптимальный уровень осмотичности питательной среды. Наиболее широко применяются растворы Эрла, Хенкса, Дюльбекко, а также фосфатно-солевой буфер,
4) поддержание необходимого уровня рН среды имеет чрезвычайно важное значение, так как в процессе метаболизма клеток уровень рН смещается, что способно оказывать повреждающее действие на клетки. Стабилизация рН на оптимальном для клеток уровне 7,3-7,35 достигается добавлением в сбалансированные солевые растворы (ССР) буферных солей – фосфатов, бикарбонатов или более сложных соединений, обладающих высокой буферной ёмкостью (HEPES). Защиту от защелачивания питательной среды дополнительно осуществляет присутствие 5 % СО2,
5) обеспечение клеток необходимыми питательными веществами и ростовыми факторами проводится с помощью питательной среды. Питательные среды для культивирования лимфоцитов и других типов клеток являются синтетическими. Они содержат все необходимые клеткам компоненты, включая аминокислоты, фосфолипидные, минеральные компоненты и т.д. Синтетические среды выпускаются фирмами-производителями в сухом виде (требуют растворения в деионизированной или бидистиллированной воде, оптимизации уровня рН и последующей стерилизации методом фильтрации через миллипоровые фильтры или автоклавированием в стандартных условиях) или в жидком, готовом к использованию виде. Выбор оптимальной среды в настоящее время не представляет трудностей, благодаря многолетним усилиям ученых и разработке ими протоколов культивирования клеток. Наиболее широко применяются среды MEM (minimal essential medium), BME (basal medium, Eagle), DMEM (Dulbecco's modified Eagle's medium), IMDM (Iscove's modified Dulbecco's medium). Для лимфоцитов человека, как правило, применяют среду серии RPMI (Roswell Park Memorial Institute) – RPMI-1640. Дополнительно в питательную среду, как правило, вносят сыворотку крови (эмбриональную телячью - ЭТС, или донорскую человека, IV (АВ) группы крови) для обеспечения нужного уровня белка, ростовых факторов и гормонов. В готовой питательной среде сыворотка крови обычно составляет 5 – 10 % от общего объёма. Сыворотку крови предварительно нужно инактивировать при +56 °С (для устранения активности комплемента) и простерилизовать методом фильтрования. При необходимости в питательную среду дополнительно вносят необходимые добавки (гормоны, витамины и проч.). Состав полной питательной среды (ППС) на основе RPMI-1640 включает 2 mM l-глутамина, 10 mM HEPES, 40-100 мкг/мл гентамицина (или смесь пенициллина – 100ЕД/мл и стрептомицина – 100 мкг/мл; иногда в среду дополнительно добавляют амфотерицин В или другой антифунгицидный препарат) и 10 % ЭТС);
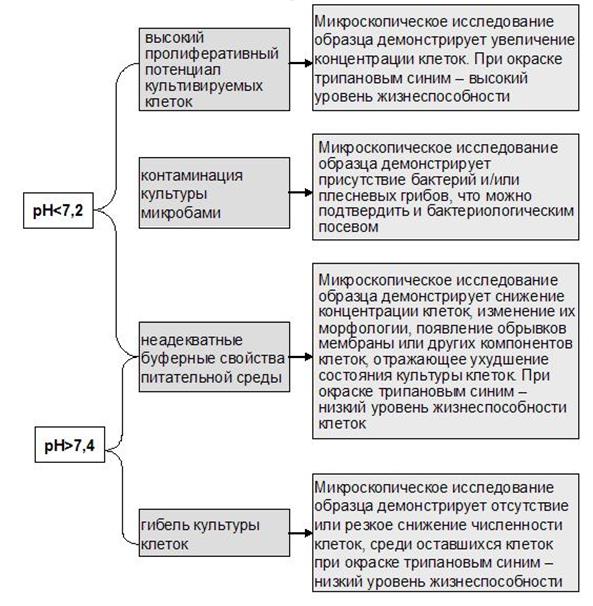
6) особые требования предъявляются также и к качеству посуды. Для культивирования клеток в целях иммунодиагностики используют 96-луночные, реже – 24-луночные (круглодонные или плоскодонные) полистироловые планшеты, реже – пенициллиновые флаконы из стекла. В процедурах предварительной подготовки клеток к культивированию используют стеклянные или пластиковые конические (центрифужные) пробирки. Желательно, чтобы используемая посуда была одноразовой. К сожалению, из-за экономических соображений это не всегда достижимо, поэтому особой проблемой является адекватная обработка посуды. Вся лабораторная посуда для культурального метода должна быть химически чистой (не содержать остатков моющих средств или реактивов, использованных ранее), рН нейтральной и стерильной. Процедуры предварительной подготовки клеток к культивированию включают сепарацию клеток из первичного биологического материала, например, лимфоцитов из периферической крови, отмывание суспензии клеток, определение жизнеспособности клеточной суспензии, определение концентрации клеток с помощью камеры Горяева доведение концентрации клеток до необходимого уровня. В процессе культивирования необходим контроль состояния культуры клеток, т.е. ее жизнеспособности и оптимальности питательной среды. Этот контроль чаще всего проводят с помощью цветной пробы. В состав питательных сред и ССР входит индикатор - феноловый красный, который позволяет в процессе роста культуры контролировать визуально изменение уровня рН. При рН=7,2-7,4 среда имеет розово-оранжевый цвет, при рН<7,2 она становится желтой, при рН>7,4 – малиново-фиолетовой. Причины изменения рН различны. Так, закисление среды отражает 1) высокий пролиферативный потенциал культивируемых клеток, что требует замены питательной среды или пассажа клеток в новую порцию среды, 2) неадекватные буферные свойства питательной среды, что может негативно повлиять на результаты иммунодиагностических процедур, 3) контаминацию культуры микробами (чаще всего, бактериями и плесневыми грибами, менее выраженный внешний эффект – при поражении культуры микоплазмами). Защелачивание среды обычно происходит при 1) гибели культуры клеток, 2) неадекватных буферных свойствах питательной среды. Дифференцировка перечисленных состояний требует как навыков, так и постановки дополнительных контролей при проведении любого иммунодиагностического метода. Так, обязательны 1) контроль питательной среды и даже ее отдельных ингредиентов и 2) контроль интактных лимфоцитов.
Рисунок 7.1
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 206; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.124.252 (0.005 с.) |