
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Повреждения технологического оборудования в результатеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Химического воздействия Обращающиеся в технологическом процессе вещества и окружающая среда вступают в химическое взаимодействие с материалом, из которого изготовлено технологическое оборудование, вызывая его разрушение. Разрушение материала в результате взаимодействия с соприкасающейся с ним средой называется коррозией. Явление коррозии чаще всего наблюдается в производствах, связанных с использованием азотной, серной, соляной кислот, уксусной кислоты и уксусного альдегида, в процессах добычи, хранения и переработки сернистых нефтей, в процессах электролиза, во время обработки жидкостей и газов, в состав которых входят галоидоводороды, кислоты, щелочи, хлористые и сернистые соли. Значительной коррозии подвержены теплообменные поверхности, омываемые пламенем, подземные и подводные части аппаратов и трубопроводов, а также аппараты и трубопроводы, находящиеся во влажной среде. Разрушающему действию коррозии наиболее подвержены слабые места производственного оборудования: швы, разъемные соединения, прокладки, места изгибов и поворотов труб. Коррозионную стойкость металлов оценивают в соответствии с ГОСТ 13819—68 «Коррозионнная стойкость металлов» по десятибалльной системе (табл. 4.2).
Таблица 4.2
Под скоростью коррозии понимают проникновение коррозии в глубину металла и рассчитывают ее (согласно данным о потере массы после удаления продуктов коррозии) по формуле П— Δ g/ρ, где Δ g — потери массы; ρ — плотность металла. При расчете оборудования на прочность предусматривают увеличение расчетной толщины стенки аппарата для компенсации потерь от коррозии, то есть принимают S = Sσ + Δ SK0p, где Sσ — расчетная толщина стенки аппарата (из условий прочности металла) без учета коррозии; Δ SK0p — прибавка на коррозию. Δ SK0p = П τ, где τ — продолжительность эксплуатации оборудования. Коррозия причиняет народному хозяйству значительный ущерб, поэтому защита от нее имеет огромное значение. Существует понятие химической коррозии и электрохимической коррозии. Химическая коррозия наблюдается в среде жидких диэлектриков или газов, нагретых до высоких температур. Это окислительно-восстановительный химический процесс, к которому относят кислородную, сероводородную, серную, а также водородную и некоторые другие виды коррозии в аппаратах с температурными режимами от 200° С и выше. При взаимодействии стали с кислородом воздуха (при повышенной температуре) образуется окалина — окислы металла: 4Fe + 3O2→2Fe2O3. (4.15) Окалина не обладает механической прочностью и легко отслаивается от металла. Скорость окисления увеличивается с повышением температуры и концентрации кислорода. Серная и сероводородная коррозия наблюдается при переработке сернистого сырья в нефтеперерабатывающей, нефтехимической, химической, коксобензольной и газовой отраслях промышленности, а также при производстве серы и сероуглерода. Коррозия происходит под действием элементарной серы с образованием сернистого железа. Сера может находиться как примесь в основном продукте, но чаще получается в результате окисления или термического разложения сернистых соединений и сероводорода. В аппаратах, работающих при 310° С и выше (печи, колонны, реакторы и т. п.), происходит диссоциация сероводорода с образованием элементарной серы, которая и взаимодействует с металлом: H2S→H24+S (термическая диссоциация); (4.16) 2H2S + O2→2H2O + 2S (окисление); (4.17) Fe+S→FeS (коррозия). (4.18) Сернистое соединение железа — пористое вещество, не обладающее механической прочностью и, кроме того, легко окисляющееся на воздухе с выделением значительного количества тепла, способного нагреть сульфиды до их самовозгорания. Водородная коррозия, характерная для процесса производства аммиака, процессов гидрогенизации, гидроочистки и риформинга нефтепродуктов, особенно сильно проявляется при высоких давлениях и температурах. Водородная коррозия относится к межкристаллитному типу. Установлен следующий механизм разрушения металла водородом. Диффузия водорода происходит в толщу металла по границам структурных зерен. При этом наблюдается частичное растворение водорода и химическое взаимодействие его с цементитом стали по следующей реакции: Fe3C+2H2→CH4+3Fe. (4.19) Этот процесс сопровождается разрушением структуры зерна и образованием мелких трещин. Образование трещин объясняется обезуглероживанием и тем, что удельный объем железа меньше удельного объема цементита. В образовавшиеся трещины проникает водород, вызывающий продолжение и ускорение процесса коррозии. Металл становится хрупким, его сопротивляемость удару и изгибу падает. Электрохимическая коррозия представляет собой процесс растворения металлов в электролитах в результате действия образующихся гальванических пар. Сущность процесса совпадает с работой гальванического элемента. Если металл не является однородным, отдельные его участки обладают различной способностью к: растворению. Чем левее расположен металл в ряду напряженности, тем легче он растворяется в электролите. Отдельные участки поверхности аппарата, соприкасаясь с электролитом, будут служить, анодом, другие — катодом. Схема коррозионного процесса, происходящего по указанному механизму, представлена на рис. 4.12.
Рис. 4.12. Схема электрохимической коррозии: 1 — катодный участок; 2 — анодный участок; 3 — поток электронов в металле; 4 — поток ионов в электролите (раствор соляной кислоты)
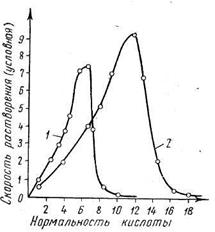
Рис. 4.13. Зависимость растворений стали от концентрации кислот: 1 — азотная кислота; 2 — серная кислота
Если неоднородный металл (например, железо плюс включения) поместить в электролит (например, в раствор соляной кислоты), то ионы более активного металла будут переходить в раствор. Участок оборудования, поверхность которого служит анодом, будет разрушаться. Отрицательные ионы электролита (в данном случае ионы хлора) перемещаются в направлении выделяющихся положительно заряженных ионов металла и, соединяясь с ними, образуют хлористую соль металла. В то же время положительно заряженные ионы электролита (водорода) перемещаются к отрицательно заряженным участкам стенки и, нейтрализуясь, образуют молекулу водорода. Количество растворившегося металла определяют по формуле Δ g=Aiτ/Фn, (4.20) где Δ g — коррозионные потери массы металла; i — коррозионный ток; Ф — постоянная Фарадея, равная 96 500 кулонам; А —атомный вес металла; п — валентность иона металла, переходящего в раствор; τ — время коррозии. Возникновение коррозии вызывается не только неоднородностью металла, но и многими другими причинами (неодинаковые деформации и напряжения в различных участках, неоднородность концентрации электролита, различные температуры отдельных участков и т. д.). На рис. 4.13 показана скорость электрохимического растворения стали. Она зависит от концентрации электролита. С повышением температуры скорость коррозии увеличивается.
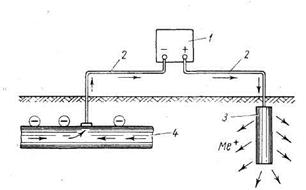
Защита от коррозии Исходя из основных закономерностей коррозионных процессов используют следующие направления борьбы с ней: применение коррозионно-устойчивых металлов; изоляция металлов от агрессивной среды защитными покрытиями; уменьшение коррозионной активности среды; использование неметаллических химически стойких материалов; катодная и протекторная защита. Применение коррозионно-устойчивых металлов. Вряде случаев необходимая коррозионная стойкость металлических конструкций достигается использованием стойкого в данной коррозионной среде и при данных условиях материала (бронза — в растворах солей, титан — в растворах уксусной кислоты любых концентраций до плюс 165° С); нержавеющие хромоникелевые стали — в окислительных средах; алюминий — в 40%-ной муравьиной кислоте (до плюс 20° С) и т. п. Рациональный выбор материала может быть сделан на основании справочных данных или специально поставленных экспериментов. С целью экономии высоколегированных нержавеющих сталей широко применяют биметалл — двухслойный материал, состоящий из двух различных металлов. Основной (толстый) слой воспринимает нагрузку. Тонкий (защитный или плакирующий) слой предохраняет основной слой от коррозионного действия среды. Улучшение коррозионной стойкости стали в ряде случаев достигается за счет повышения однородности структуры соответствующей термической обработкой, устранением мест концентрации внутренних напряжений и деформаций или тонкой механической обработкой поверхности (шлифованием, полированием). Изоляция металла от агрессивной среды защитными покрытиями используется в технологическом процессе наиболее часто. Металл покрывают лаками, нитрокрасками, масляными, глифталевыми и полихлорвиниловыми красками. От почвенной коррозии сооружения и трубопроводы защищают битумопековыми обмазками. Защиту поверхностей от коррозии осуществляют также путем нанесения тонких металлических пленок (никелированием, лужением, хромированием, серебрением, золочением) и при помощи футеровки—внутренней облицовки аппаратов химически стойкими материалами: керамической плиткой, графитом, свинцом, алюминием, пластическими массами, резиной, эбонитом, торкрет-бетоном и т. п. Основной недостаток футеровки заключается в наличии швов, стыков и мест крепления, которые наиболее часто повреждаются. Уменьшение коррозионной активности среды осуществляется путем очистки обрабатываемых веществ от агрессивных примесей, а также введением замедлителей коррозии — ингибиторов. Очистку от агрессивных примесей осуществляют путем отстаивания, фильтрации, химическим путем, а также при помощи абсорбции и адсорбции. Все эти способы требуют применения специальных установок и затрат значительного количества энергии. В качестве ингибиторов экономически выгодно применять органические или неорганические соединения, например, уротропин, декстрин, хроматы, нитраты, фосфаты металлов, образующие на поверхности металла различного вида защитные пленки. Содержание ингибитора в обрабатываемых веществах обычно не превышает 0,01...1%. Уменьшения почвенной коррозии можно добиться путем снижения ее влажности обушкой, засыпкой мест установки аппаратов и прокладки трубопроводов битуминозными землями. Применение неметаллических химически стойких материалов нашло широкое распространение. Используются пластические массы, искусственные смолы и резины, полиэтилен, полипропилен, поливинилхлорид, полистирол, капрон, фторопласты, эбонит, сложные пластики и другие природные неорганические материалы (гранит, базальт), а также искусственно получаемые силикатные материалы (фарфор, стекло, ситалл, керамика, цемент). Неметаллические материалы применяют не только для футеровки металлических аппаратов, но и для изготовления корпусов аппаратов, труб, насосов, отдельных узлов и деталей технологических установок. Установки катодной и протекторной защиты от электрохимической коррозии предназначены для подавления анодных участков на защищаемом сооружении. Эти установки позволяют создать разность потенциалов между защищаемым сооружением и грунтом, при которой все сооружение становится катодом. Для возникновения разности потенциалов отрицательный полюс источника постоянного тока соединяют с защищаемым сооружением, а положительный полюс через электроды заземлители (анодное заземление) соединяют с грунтом (рис. 4.14). Таким образом, вся поверхность металлического подземного сооружения становится катодом и предохраняется от коррозионного разрушения. Активному разрушению подвергается анодное заземление, которое обычно выполняют из металлолома (старых труб, рельсов). Для установки катодной защиты используют источники постоянного тока напряжением 6—12 В, обеспечивающие плотность защитного тока от 2 до 20 мА на 1 м2 защищаемой поверхности. При хорошей битумной изоляции поверхности защищаемого участка одна катодная установка может защитить трубопровод протяженностью от 10 до 20 км или 5...10 резервуаров емкостью 5000...10 000 м3 каждый. Благодаря высокой эффективности катодная защита находит все более широкое применение. Магистральные газопроводы и нефтепроводы большой протяженности без катодной защиты в эксплуатацию не вводятся. Срок службы трубопровода, имеющего катодную защиту, увеличивается на 20 и более лет.
Рис. 4.14. Схема катодной защиты: 1 — источник тока; 2 — провод; 3 —анодное заземление; 4 —защищаемое сооружение
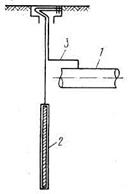
Рис. 4.15. Протекторная защита подземного трубопровода: / — трубопровод; 2 — автономный анод (протектор); 3 — провод
Протекторную защиту (рис. 4.15) выполняют при помощи присоединения к защищаемому сооружению гальванических анодов — протекторов, электрохимический потенциал которых ниже, чем у защищаемого сооружения. Протекторная защита не требует источников тока (что снижает эксплуатационные расходы) и обеспечивает взрывобезопасность. При протекторной защите электрический ток необходимого направления получается в результате создания искусственных гальванопар, у которых катодом является защищаемый металл, анодом — чистые металлы (цинк, магний, алюминий). Аноды изготовляют в виде пластин, стержней, труб и размещают на расстоянии 1...5 м от защищаемого объекта с шагом 20 м. Длительность работы протекторов определяется по формуле
где Gη — масса протектора; i п.3— сила тока протекторной защиты; т; η — КПД протектора; kпр — практический расход протектора. Для повышения эффективности работы протектора его помещают в специально приготовленную смесь солей, глины и воды (активатор). За состоянием аппаратуры, работающей в условиях, вызывающих коррозию материала, устанавливают соответствующий надзор путем периодического осмотра и контрольного определения толщины стенок, то есть величины износа. Результаты проверки состояния аппаратов или трубопроводов записывают в специальный журнал.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1343; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.01 с.) |


 , (4.21)
, (4.21)


