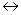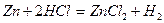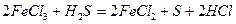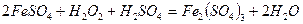Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекція 5. Окисно-відновні реакціїСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакції, які розглядалися раніше (обмінні, гідроліз), перебігають без зміни ступеня окиснення елементів.
Реакції, в яких ступінь окиснення елементів не змінюється, називаються реакціями невалентних перетворень.. Пригадаємо поняття валентність і ступінь окиснення. Ступінь окиснення – умовний заряд, який мав би атом, якби електрони всіх його зв'язків з рештою атомів були зміщені до більш електронегативного елемента. Тобто рід ступенем окиснення розуміють електричний заряд атома, розрахований виходячи з допущення, що дана сполука складається з іонів. Тому ступінь окиснення може бути як позитивним, так і негативним. Ступінь окиснення позначають арабськими цифрами із знаком «+» або «-» перед числом і пишуть над символом елемента: Н+, Na+, Cl-, Mg2+, P5+. Ступінь окиснення можна приписувати елементам як в іонних, так і в ковалентних сполуках. Чисельне значення ступеня окиснення визначається декількома правилами. 1. Ступінь окиснення дорівнює: - вільного елемента: 0 (О2 - 0, Р5 - 0); - одноатомного простого іона: рівний заряду іона (Cl -); - атома водню в сполуках з неметалами: +1; - атома кисню (окрім Н2О2 -1 і ОF2 +2): -2; - атома фтору (самий електронегативний): -1; - лужних металів у всіх сполуках: +1; - лужноземельних металів у всіх сполуках: +2; - атома алюмінію: +3.
2. Сума ступенів окиснення всіх елементів в сполуці дорівнює нулю. 3. Ступінь окиснення елемента, що утворює оксоаніон дорівнює (2*число атомів кисню в оксоаніоні) мінус абсолютне значення заряду іона: MnO4– іон (2*4)-1=7
Поняття ступінь окиснення не треба прирівнювати до поняття валентність, навіть коли вони чисельно співпадають.
Валентність – це число електронів, що використовуються атомом при утворенні хімічного зв'язку. Валентність атома рівна числу електронів, що втрачаються ним при утворенні катіона або приєднуваних до нього при утворенні аніона. Валентність атомів в ковалентній молекулі дорівнює числу електронів, узагальнених ним при утворенні зв'язків з іншими атомами. Валентності завжди дорівнюють невеликим цілим числам. Негативної валентність не буває, окрім інертних газів, які в звичайних умовах не утворюють сполук з іншими елементами. Іноді валентності чисельно співпадають із ступенем окиснення, але частіше не співпадають. Особливо чітко це видно на прикладі органічних сполук. Наприклад: валентність вуглецю в сполуках майже завжди 4, а ступінь окиснення змінюється від –4 до +4: Метан СН4 (-4); хлорметан СН3Cl (-2); дихлорметан CH2Cl2 (0); тетрахлорметан CCl4 (+4).
Повернемося до поняття «ступінь окиснення». Не зважаючи на формальний характер, він широке використовується в класифікації хімічних процесів, при розгляді окислювально-відновних здібностей речовин, при розрахунках коефіцієнтів в окисно-відновних реакціях.
Окисно-відновними реакціями називаються процеси, в яких електрони переходять від атомів одного елемента до атомів іншого. Ці реакції супроводжуються зміною ступеня окиснення елементів. В окисно-відновних реакціях зміна ступеня окиснення обумовлена зсувом або повним переходом електронів від атома одного елемента до атома іншого елемента. Наприклад: 2Н20 + О20 = 2Н2+1О-2 Реакція супроводжується переходом двох електронів від атомів гідрогену до оксигену і останній отримує стабільну електронну конфігурацію s2p6, переходячи в іон О-2. Атоми гідрогена одержують позитивний заряд. Таким чином, окисно-відновна реакція супроводжується перенесенням електронів. Процес втрати частинкою електронів називається окисненням, а процес приєднання електронів – відновленням. При окисленні атома елемента або іона відбувається зростання його ступеня окиснення: Fe+2 + e = Fe3+. При відновленні атома або іона відбувайся зменшення його ступеня окиснення: Си2++ 2е=Си0. В хімічних реакціях ці два процеси відбуваютьсяч одночасно і тому окисно-відновні реакції є єдністю двох протилежних тенденцій, тобто в наявності чітке дотримання закону збереження матерії.
Речовини, що містять елементи, які приєднують електрони, називаються окисниками. Речовини, в яких елементи віддають електрони, називаються відновниками. До окисників відносяться речовини, що мають тенденцію до приєднання електронів. Всі окисники містять елемент, електронна конфігурація якого не стабільна, а для утворення стійкої конфігурації (наприклад: s2p6) не вистачає одного або декількох електронів. Окисники приєднують бракуючі електрони і знижують свій ступінь окиснення. До окисників відносяться: кисень, галогени, кисневмісні кислоти, хлор, бром і їх солі, азотна кислота і її солі, марганцева кислота і її солі,сполуки деяких металів у вищих ступенях окиснення (K2Cr2O 7 ,PbO2,,Fe3+), концентрована сульфатна кислота, перекис водню. До відновників відносяться речовини, здатні віддавати електрони. Тобто у них електронна конфігурація повинна бути нестійкою. Легше віддають електрони ті елементи, конфігурація електронів в яких s1 або s2, тобто ті, що знаходяться на початку періодичної системи. До відновників відносяться: водень, метали, сірководень і його солі, солі Fe2+, тобто речовини, які містять атоми в низьких ступенях окиснення. Речовини з атомами в проміжних ступенях окиснення, можуть бути як окисниками, так і відновниками: SO2, H2SO3. До окисно-відновних можуть бути віднесений реакції наступних типів: 1. металів з неметалами:
2. металів з кислотами:
3.металлов з водою:
4. заміщення (витіснення):
5. реакції між двома речовинами, що знаходяться у вищому і нижчому ступенях окиснення:
Всі перераховані реакції можуть бути розділений на три типи: 1. міжмолекулярної взаємодії: окисник і відновник належать різним молекулам
2. внутрішньо молекулярної взаємодії: окисником і відновником є елементи однієї молекули:
3.диспропорционування або самоокиснення-самовідновлення: один і той же елемент є і окисником і відновником, тобто він і підвищує і знижує свій ступінь окиснення:
При складанні рівнянь окисно-відновних реакцій застосовують два методи: - метод електронного балансу (його часто застосовують в школі); - іонно-електронний метод.
В методі електронного балансу підрахунок числа приєднаних електронів робиться на підставі знань ступенів окиснення елементів до і після реакції
При складанні рівнянь окисно-відновних реакцій, що протікають у водних розчинах правильніше користуватися іонно-електронним методом. Цей метод базується на складанні окремих рівнянь реакцій відновлення іона або молекули і окиснення іона або молекули з подальшим складанням цих реакцій в одне загальне. Для цього необхідна іонна схема: сильні електроліти пишуть у вигляді іонів; слабкі електроліти, осади і гази у вигляді молекул. Ті іони, які не зазнають змін в результаті реакції в іонну схему не вносяться. Порядок складання іонних рівнянь окисно-відновних реакцій 1. скласти іонну схему реакції 2. скласти електронне рівняння процесу окиснення і процесу відновлення так, щоб сума алгебраічнихзарядів зліва і праворуч від знака рівності була однаковою 3. знайти коефіцієнти для окисника і відновника, враховуючи, що число електронів, що втрачаються відновником, повинне дорівнювати числу електронів, приєднуваних окисником. 4. скласти електронні рівняння, заздалегідь помноживши їх на знайдені коефіцієнти. Приклад окисно-відновної реакції з участю солі безкисневої кислоти:
Окисно-відновні реакції часто протікають між іонами або молекулами, які містять оксиген. В результаті змінюється вміст кисню в молекулах окисника і відновника. В цьому випадку в рівнянні реакції з'являються іони Н+ або ОН -, тобто ми говоримо про те, що дана реакція перебігає в якомусь середовищі: кислому (іони Н+), лужному (іони ОН -), нейтральному (молекули Н2О).
Перевірити, чи правильно розставлені коефіцієнти в рівнянні можна по кількості атомів оксигену зліва і справа від знака рівності. Якщо окисно-відновний процес перебігає в лужному середовищі, в схему для створення середовища додається луг.
Якщо до вихідних речовин не додається ні кислота, ні луг, то вважають, що окисно-відновна реакція проходить в нейтральному середовищі. В цьому випадку в лівій частині схеми враховується вода
Деякі особливі випадки окисно-відновних реакцій - реакції диспропорціонування
реакції, ускладнені утворенням солей
- реакції з участю перекису водню
Лекція 6: ЗАГАЛЬНІ ПОНЯТТЯ МАТЕРІАЛОЗНАВСТВА
Матеріалознавство – це прикладна наука про будову і властивості технічних матеріалів, основна задача якої – встановлення зв’язку між складом, структурою та властивостями. Розвиток техніки вимагає постійного розширення переліку матеріалів, які в ній використовуються; разом з традиційними матеріалами, що забезпечують певний комплекс механічних та технологічних властивостей, з'являються нові матеріали з особливими властивостями. До них можливо віднести магнітні, тепломіцні і тугоплавкі порошкові матеріали; напівпровідникові матеріали; матеріали атомної техніки; композиційні матеріали; надпровідники; полімерні матеріали; ситали та таке інше. Для більшості технічних матеріалів як металевих, так і неметалевих характерна кристалічна будова. Це дозволяє з єдиних позицій розглянути закономірності формування кристалічної будови і властивості, шо визначаються природою зв'язку між атомами.
Всі тверді тіла ділять на кристалічні і аморфні. Кристалічні тіла при нагріві залишаються твердими до певної температури (температури плавлення), при якій вони переходять в рідкий стан. Аморфні тіла при нагріві розм'якшуються у великому температурному інтервалі; спочатку вони стають в'язкими і лише потім переходять в рідкий стан. Всі метали і їх сплави - тіла кристалічні.
|
||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 511; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.116.142 (0.008 с.) |