
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекція 4: добуток розчинності. Іонний добуток води, водневий показник. Гідроліз солейСодержание книги
Поиск на нашем сайте
Розглянемо особливостіповедінки розчинів електролітів. Візьмемо, наприклад, насичений розчин малорозчинної солі-барій сульфату. Між осадом ВаSO4 та іонами Ва2+ та SO42-, що знаходяться в розчині, встановлюється динамічна рівновага:
тверда фаза насичений розчин Примінимо до цієї рівноваги закон діючих мас та запишемо вираз для константи рівноваги:
Тому що
Таким чином, в насиченому розчині важкорозчинного електроліту добуток концентрації його іонів при даній температурі є величина постійна, яка називається добутком розчинності і позначається ДР.
Значення ДР –величини з довідника. Величина ДР характеризуєздібність електроліту розчинятися. З величини ДР електроліту можна визначити його розчинність, та навпаки, з розчинності можна визначити величину ДР (розчинність виражають в моль/л). Для того, щоб визначити розчинність солі в моль/л, треба написати рівняння дисоціації солі. Розглянемо дисоціацію аргентум карбонату:
Тепер запишемо вираз для ДР:
Коло концентрації іонів
Визначивши масу Поняття ДР широко використовується в аналітичній хімії для аналізу різних сполук. Зі значенням ДР пов’язані так звані якісні реакції (на солі Треба пам’ятати, що осад випадає тільки в тому разі, коли добуток концентрацій утворених іонів буде більше ДР: ІД>ДР. Повернемося до
Не дивлячись на те, що ми весь час кажемо, що вода — це диполь, тобто заряди в ній розподілені на два полюси, але чиста вода, що не містить ніяких домішок, у вигляді солей або інших електролітів, погано проводить електричний струм. Однак, сучасні чутливі прилади дозволяють вимірювати електропровідність води. Тому доля молекул все ж розпадається на іони за схемою:
Запишемо
Але для води та водних розчинів
К іонний добуток води Отримане рівняння показує, що для води та розведених розчинів при постійній температурі добуток концентрації гідроген — іонів та гідрооксид-іонів є величина постійна, яка називається іонним добутком води. З величин електропровідності були визначені концентрації гідроген — і гідроксид-іонів, що дорівнюють Якщо На практиці використання показника ступеню у виразі концентрації не зручно. Тому використовують десятковий логарифм цієї концентрації з протилежним знаком. Ступінь кислотності чи лужності розчину прийнято виражати не концентрацією іонів гідрогену, а її десятковим логарифмом, що взятий з протилежним знаком. Цю величину називають водневим показником, та позначають через pH:
Для кислих розчинів pH<7, тому що
Зараз дуже часто згадують про pH, коли обговорюють осади: дощі кислі, нейтральні та лужні. Виміряти pH можна за допомогою скляних електродів, потенціал яких змінюється в залежності від активності катіонів Приблизне значення pH можна визначити за допомогою кислотно-основних індикаторів.
|
||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 529; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.006 с.) |


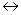



 , то це значення ми переносимо до
, то це значення ми переносимо до 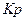 :
:




 з’являється показник ступеня. Якщо концентрація
з’являється показник ступеня. Якщо концентрація  моль/л, то
моль/л, то  , а
, а ;
;  .
. -
- , на
, на  моль/л;
моль/л;  , то
, то осад не випадає, а якщо
осад не випадає, а якщо  осад випаде.
осад випаде.


 , тому перенесемо її до
, тому перенесемо її до 


 при
при  . Також, як константа рівноваги,
. Також, як константа рівноваги,  ¦
¦  при
при 
 .
. , тобто
, тобто  тощо, то розчин кислий. Якщо
тощо, то розчин кислий. Якщо  , а
, а  — розчин лужний. Але, яким би не було середовище розчину, добуток концентрації гідроксид — та гідроген — іонів залишається рівним
— розчин лужний. Але, яким би не було середовище розчину, добуток концентрації гідроксид — та гідроген — іонів залишається рівним  .
.

 . Для лужних розчинів pH>7, тому що
. Для лужних розчинів pH>7, тому що 
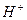 в розчині (pH — метри або потенціометри).
в розчині (pH — метри або потенціометри).


