Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра: харчових технологійСодержание книги
Поиск на нашем сайте
Факультет: хімічний Кафедра: харчових технологій Спеціальність: ТЗ Курс: перший Назва дисципліни: хімія та основи матеріалознавства Викладач: доц.Полонський В.А. Металами називають хімічні елементи, характерними ознаками яких є непрозорість, блиск, високі електро- і теплопровідність, пластичність, а для багатьох металів також здатність зварюватися. Не втратило свого наукового значення визначення металів, дане більше 200 років тому великим російським вченим М. В. Ломоносовим: "Метали суть світлі тіла, які кувати можна". Для металів характерний те, що, вступаючи в хімічні реакції з елементами, неметалами, що є, вони віддають останнім свої зовнішні валентні електрони. Це пояснюється тим, що у атомів металу зовнішні електрони неміцно пов'язані з його ядром. Метали мають на зовнішніх оболонках всього 1-2 електрони, тоді як у неметалів таких електронів багато (5—8). Чисті хімічні елементи металів (наприклад, залізо, мідь, алюміній і ін.) можуть утворювати складніші речовини, до складу яких можуть входити декілька елементів-металів, часто з домішкою помітних кількостей елементів-неметалів. Такі речовини називаються металевими сплавами. Прості речовини, створюючі сплав, називають компонентами сплаву. Частинки речовини (іони, атоми), з яких побудований кристал, розташовані в певному геометричному порядку, який періодично повторюється в просторі. На відміну від кристалів в аморфних тілах (стекло, пластмаси) атоми розташовуються в просторі безладно, хаотично. Для опису кристалічної структури металів користуються поняттям кристалічної гратки. Кристалічна гратка - це уявна просторова сітка, у вузлах якої знаходяться атоми або іони, які утворюють метал. Формування кристалічних граток в металі відбувається таким чином. Під час переходу металу з рідкого в твердий стан відстань між атомами скорочується, а сили взаємодії між ними зростають. Характер взаємодії атомів визначається будовою їх зовнішніх електронних оболонок. При зближенні атомів електрони, що знаходяться на зовнішніх оболонках, втрачають зв'язок з своїми атомами унаслідок відриву валентного електрона одного атома позитивно зарядженим ядром іншого і т.д. Відбувається утворення вільних електронів, оскільки вони не належать окремим атомам. Таким чином, в твердому стані метал є структурою, що складається з позитивно заряджених іонів, оточених вільними електронами. Зв'язок в металі здійснюється електростатичними силами. Між іонами і вільними електронами виникають електростатичні сили притяжіння, які стягують іони. Такий зв'язок між частинками металу називають металевим. Сили зв'язку в металах визначаються силами відштовхування і силами притяжіння між іонами і електронами. Іони знаходяться на такій відстані один від одного, при якому потенційна енергія взаємодії мінімальна. В металі іони розташовуються в певному порядку, утворюючи кристалічну гратку. Таке розташування іонів забезпечує взаємодію їх з валентними електронами, які зв'язують іони в кристалічних гратках. Рис.3 Основні системи кристалів
В кубічній системі всі кути елементарної комірки прямі і всі її ребра однакової довжини. Основними формами кубічної системи є куб і октаедр (див. рис. 5). Для кристалів цієї системи існують три решітки: проста, об'ємноцентрована та гранецентрована. В кубічній системі кристалізується значна кількість металів (літій, залізо, мідь), деякі неметали (алмаз, кремній) та багато неорганічних сполук (NaCl, KC1, ZnS). В тетрагональній системі всі кути між ребрами елементарної комірки дорівнюють 90°. Довжини двох ребер елементарної комірки однакові за величиною і утворюють квадрат. Довжина третього не дорівнює довжині двох перших. Основні форми кристалів — квадратна призма та біпіраміда з квадратною основою (див. рис. 5). У цій системі кристалізуються Sn, SnO2 тощо. В гексагональній системі довжини двох ребер кристала однакові, а кути між ними дорівнюють 120°. Третє ребро знаходиться під кутом 90° і його довжина не дорівнює довжинам двох перших. Основні форми кристалів: гексагональна призма та біпіраміда (див. рис. 5). У гексагональній системі кристалізуються деякі метали (Zn, Hg) і сполуки (SiO2, HgS, NaNO3 тощо). Геометричні характеристики кристалів інших сингоній наведено на рис. 3. Типи кристалічних граток.
В залежності від природи частинок, що містяться у вузлах кристалічної гратки, а також від характеру сил між ними, розрізняють такі основні типи кристалічних граток: іонні, атомні, молекулярні і металічні.
У вузлах іонних граток розміщені іони протилежного знаку, зв'язані силами електростатичного притягання. Зазначимо, що чисто іонний зв'язок в кристалах не реалізується. В іонних сполуках завжди є також ковалентний зв'язок, а частка іонного зв'язку не перевершує 80—90 %. Наприклад, в кристалі NaCI частка іонного зв'язку не перевершує 82%, а в максимально іонній сполуці CsF частка іонного зв'язку становить 93%. В іонних решітках можуть міститися прості іони (кристал NaCI) і складні (кристал NH4NO3).
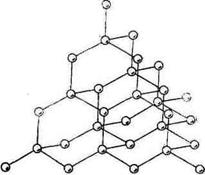
Рис.4.Кристалічна гратка алмазу
Як зазначалось, внаслідок ненасиченості і ненапрямленості іонного зв'язку іонні кристали характеризуються великими координаційними числами. До сполук з іонними гратками належать більшість солей і невелика кількість оксидів. Іонні гратки міцніші за молекулярні, проте слабкіші за атомні. Іонні сполуки характеризуються досить високими температурами плавлення і кипіння; розчини і розплави їх мають високу електропровідність.
У вузлах атомних граток містяться атоми, зв'язані між собою ковалентним зв'язком. До речовин з атомними гратками належать алмаз (рис. 4), кремній, бор і деякі неорганічні сполуки. Будова ковалентних кристалів визначається типом гібридизації орбіталей атомів, які входять до їх складу. Речовини з атомними гратками характеризуються високими температурами плавлення, великою твердістю і практично нерозчинні у жодному з розчинників. У вузлах молекулярних граток розміщені молекули, зв'язані між собою міжмолекулярними силами. До речовин з молекулярними гратками належать неметали (крім вуглецю і кремнію), всі органічні сполуки з неіонним зв'язком і багато неорганічних сполук. У сполуках, які містять атомні групи F—Н, О—Η, Ν—Н, структура кристалів в основному визначається водневим зв'язком. Сполуки з молекулярними гратками мають невелику твердість,.легкоплавкі і леткі.
У вузлах металічних граток містяться атоми металів, між якими вільно рухаються електрони. Для них найхарактерніші такі три типи кристалічних решіток (рис. 5): кубічна гранецентрована а (к.ч. 12), гексагональна б (к.ч. 12) та кубічна об'ємноцентрована в (к. ч. 8). Є речовини, в кристалах яких значну роль відіграють два види взаємодії між складовими частинками. Так, у графіті атоми вуглецю зв'язані між собою в одних напрямках ковалентним зв'язком, а в інших — металічним. Тому гратку графіту можна розглядати і як атомну, і як металічну. У деяких неорганічних сполуках (наприклад, BeO, ZnS. CuCl) зв'язок між частинками, що містяться у вузлах гратки, частково іонний, а частково ковалентний. Тому такі гратки можна розглядати як проміжні між іонними і атомними. Типи кристалічних грат у різних металів різні найбільш часто зустрічаються гратки: об'ємно-центрована кубічна (ОЦК) - а-Fe, Cr, W, гранецентрована кубічна (ГЦК) - г-Fe, А1, Си і гексагональна щильноупакована (ГЩУ) - Mg, Zn і ін. Кристалічна гратка характеризуються певними параметрами, наприклад довжиною ребра куба для ОЦК і ГЦК, яка складає для металів 2,8-6· 10-8 см.
а б в
Рис. 5. Кристалічні гратки металів
Факультет: хімічний Кафедра: харчових технологій Спеціальність: ТЗ Курс: перший
|
||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 303; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.92.5 (0.006 с.) |