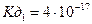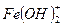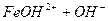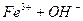Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основні індикатори — це речовини, які змінюють забарвлення в залежності від pH речовину.Содержание книги
Поиск на нашем сайте
Найчастіше такими речовинами є або слабкі кислоти або слабкі основи. Як індикатори використовують такі кислоти, забарвлення яких досить відрізняється від забарвлення відповідної їм основи. Процес переходу кислоти в основу рівноважний, тому, якщо додавати надлишок Найчастіше використовувані індикатори: 1. тимоловий синій (червона - жовта); перша зміна при друга зміна (жовта – синя): 2. метиловий оранжевий (червона - жовта): 3. бромкрезоловий зелений (жовта - синя); 4. метиловий червоний (жовта - червона); 5. бромтимоловий синій (жовта-синя); 6. тимоловий червоний (жовта-червона); 7. фенолфталеїн (безбарвна-рожева); Як ви бачите, індикатори змінюють забарвлення в дуже вузькому інтервалі Буферні розчини або буфери — це розчини, Таких розчинів — 4 види: 1. буферні розчини, що містять сильну кислоту 2. буферні розчини, що містять сильну основу 3. буферні розчини, що містять слабку кислоту 4. буферні розчини, що містять слабку основу Буферні речовини мають важливе значення в багатьох технологічних процесах: захисні покриття, виробництво барвників, фотоматеріалів, хімічний аналіз Більшість біологічних систем представляє собою буферні розчини, які підтримують постійне Ось деякі природні буферні системи: 1. кров людини 2. слина 3. шлунковий сік 4. молоко 5. морська вода 6. томатний сік 7. сльози 8. сеча 9. білок курячого яйця 10. апельсиновий сік Для різних рослин необхідний З процесом дисоціації води пов’язаний такий процес, як гідроліз солей. Гідролізом взагалі називається взаємодія речовини з водою, при якій складові частини речовини об’єднуються зі складовими частинами води. Гідролізу підпадають сполуки різних класів, однак ми розглянемо тільки гідроліз солей.
Давайте згадаємо, як одержують солі. Їх одержують в результаті взаємодії кислоти та лугу, тобто в результаті реакції нейтралізації. Тепер ми з вами знаємо про такий параметр, як водневий показник, або або Взаємодія іонів солі з водою, що супроводжується зміною концентрацій гідроген - та гідроксид - іонів води називається гідролізом солі. Основною причиною гідролізу є утворення малодисоційованих речовин (молекул або іонів). Гідроліз перебігає по-різному, в залежності від сили кислоти та основи, з яких утворилася сіль:
З того, що процес гідролізу — це процес зворотній слід, що для нього можна визначити
З того, що
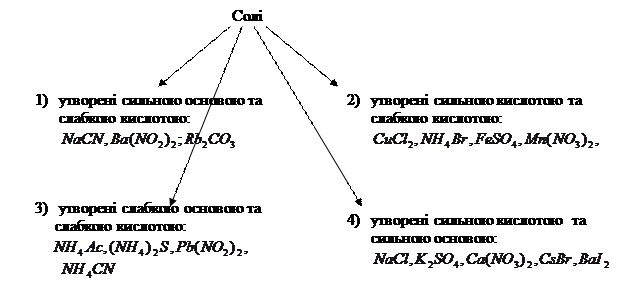
Значення В залежності від сили вихідних кислоти чи основи солі можна розподілити на 4 типи:
Солі 1,2,3 типів підлягають гідролізу, солі 4-го типу — не підлягають гідролізу. Розглянемо гідроліз солей кожного типу: 1)
гідроліз іде по аніону (середовище має такий самий знак).
Чим більш слабкою буде кислота, тим сильніше її солі підлягають гідролізу. 2)
Таким чином, в розчині накопичиться надлишок іонів середовище кисле, а гідроліз іде по катіону.
Чим більш слабка основа, тим в більшому ступені підлягають гідролізу
солі, що утворені нею. 3)
гідроліз іде по аніону і катіону.
Чим більш слабкі кислота і основа, тим більш буде підлягає гідролізу. 4)
Тому, процес гідролізу солей, що утворені сильною кислотою та сильною основою зведений до процесу дисоціації молекул води і вести розмову про гідроліз не можна. Гідролізу не підлягають, тому що рівновага між недисоційованими молекулами і іонами води не порушується. Для перших трьох типів солей гідролізу підлягає не вся кількість солі, що знаходиться в розчині, а лише її частка. Тобто, в розчині встановлюється динамічна рівновага між сіллю і утвореною кислотою або основою. Таким чином, стан гідролізу може бути охарактеризований ступенем гідролізу. Ступінню гідролізу солі називається відношення числа гідролізованих молей солі до загальної кількості молей солі, що знаходяться в розчині:
Ступінь гідролізу Підвищення температури розчину солі або зменшення його концентрації, тобто розведення розчину, може значно посилити гідроліз. Крім того, ослабленню гідролізу сприяє підкислення або підлуження розчинів. До цього ми розглядали гідроліз солей, що перебігають в одну стадію. Що ж відбувається, коли солі і змістити рівновагу в сторону продуктів гідролізу. Зміщенню рівноваги в сторону вихідних речовин, тобто ослаблення його, сприяє зниження З цього вибігає, що зберігати розчини для ослаблення процесу сіль містить більше 1-го катіону, чи аніону. Гідроліз солей, утворених слабкою багатоосновною кислотою або слабкою багатокислотною основою, перебігає поступово, декілька стадій. Розглянемо в тому ж порядку, що й одноосновні і однокислотні сполуки. 1)
Порівняно з
Як ви пам’ятаєте Треба пам’ятати, що стадій гідролізу завжди на одиницю менше, ніж заряд самого багатозарядного іона (виняток 2)
3) більш глибоко іде гідроліз солей, що утворені слабкою кислотою та слабкою основою:
Гідроліз йде в одну стадію і до кінця, тому що гідроліз катіона і аніона підсилюється один одним і рівновага зміщується в сторону утворення кінцевих продуктів. Важливим є процес посилення гідролізу в результаті реакції обміну між солями. Наприклад:
Повинна була б утворитися сіль — алюміній сульфід, але ви пам’ятаєте, що гідроліз такої солі йде до кінця, тому в реакції обміну утворюються одразу продукти гідролізу солі. Таке відбувається для солей, в таблиці розчинів яких стоїть риска. Довідка: Для
Для
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 556; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.252.50 (0.011 с.) |

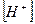 - іонів — забарвлення одне, а для надлишку
- іонів — забарвлення одне, а для надлишку 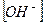 - іонів — інше.
- іонів — інше.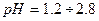
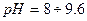
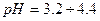

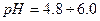
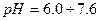
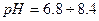
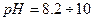
 , тому найчастіше використовують універсальний індикатор — це суміш індикаторів, яка дає поступову зміну забарвлення в широкому діапазоні
, тому найчастіше використовують універсальний індикатор — це суміш індикаторів, яка дає поступову зміну забарвлення в широкому діапазоні  .
. .
.
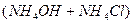
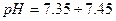

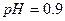
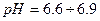
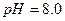
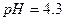
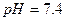
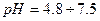

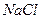
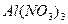 реакція середовища буде нейтральною. Однак це припущення справедливе лише для першої солі, а для другої — реакція середовища буде кислою. Чому це відбувається? Іонна теорія пояснює: різне середовище в результаті гідролізу солі обумовлене взаємодією води з іонами розчинної солі, при якій утворюється надлишок гідроген- або гідроксид-іонів. Хоча концентрація
реакція середовища буде нейтральною. Однак це припущення справедливе лише для першої солі, а для другої — реакція середовища буде кислою. Чому це відбувається? Іонна теорія пояснює: різне середовище в результаті гідролізу солі обумовлене взаємодією води з іонами розчинної солі, при якій утворюється надлишок гідроген- або гідроксид-іонів. Хоча концентрація 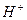 - та
- та  - іонів в розчині дуже мала, але вони знаходяться в стані рівноваги з великою кількістю недисоційованих молекул води. З’єднання одного з цих іонів з іонами солі порушує рівновагу та визиває дисоціацію нових молекул води. А в результаті в розчині накопичуються іони іншого виду і розчин набуває чи кислу, чи лужну реакцію.
- іонів в розчині дуже мала, але вони знаходяться в стані рівноваги з великою кількістю недисоційованих молекул води. З’єднання одного з цих іонів з іонами солі порушує рівновагу та визиває дисоціацію нових молекул води. А в результаті в розчині накопичуються іони іншого виду і розчин набуває чи кислу, чи лужну реакцію.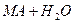
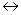
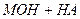
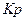 або
або 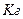 солі:
солі: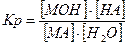 .
. для розведених розчинів, слід, що:
для розведених розчинів, слід, що: .
.
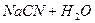
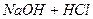
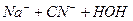
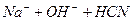
 — визначається праворуч — лужне.
— визначається праворуч — лужне.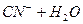
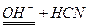

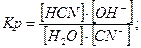
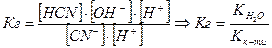
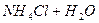


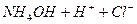
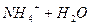

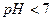 , тобто
, тобто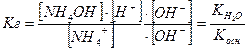
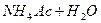
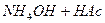
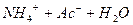
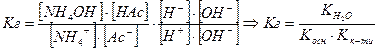
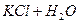


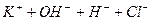


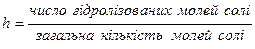
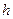 залежить від
залежить від 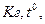 концентрації солі.
концентрації солі. 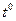 розчину і підвищення концентрації солі.
розчину і підвищення концентрації солі.


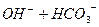

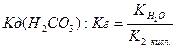
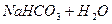
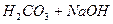
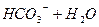
 I I ст.
I I ст.
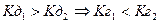 . Тому гідроліз по першій стадії завжди перебігає в більшому ступені, ніж по другій. Гідроліз по третій стадії — проблематичний.
. Тому гідроліз по першій стадії завжди перебігає в більшому ступені, ніж по другій. Гідроліз по третій стадії — проблематичний.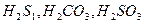 )
)

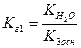
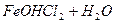

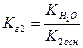
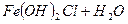
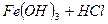 - практично не іде
- практично не іде 
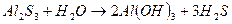
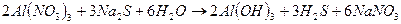
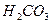 :
: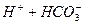
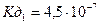
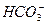
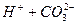
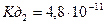
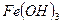 :
: