
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие в однокомпонентной двухфазной системе.Содержание книги
Поиск на нашем сайте
Уравнение Клаузиуса-Клапейрона Рассмотрим двухфазную однокомпонентную систему. При равновесии в соответствии с теоремой равновесия Гиббса:
Так как состав фаз постоянен, то химический потенциал компонента зависит только от внешних параметров р и Т:
Продифференцировав, получим
Так как химический потенциал чистого компонента – есть парциальная мольная энергия Гиббса (
где
Преобразуем:
Разность
Изменение энтропии при фазовом превращении
где Тф.п. – температура фазового перехода, следовательно,
Полученное уравнение (2.6) – уравнение состояния однокомпонентной двухфазной системы Клаузиуса-Клапейрона. Применим полученное уравнение к различным процессам. В процессе плавления производная dp/dT показывает, на какую величину нужно изменить давление, чтобы изменить температуру плавления вещества на 1 градус. Для большинства веществ плотность ρ т > ρ ж, тогда Для процесса возгонки твердого вещества или испарения жидкости можно допустить, что
тогда уравнение (2.6) запишется:
Разделив переменные и проинтегрировав в определенных пределах в узком интервале температур, считая
где На основе полученного уравнения (2.7) можно рассчитать: 1) температуру кипения вещества Т2 под давлением р2, если известна температура кипения Т1 этого вещества под давлением р1 и величина средней мольной теплоты испарения; 2) давление насыщенного пара индивидуального вещества р2 при температуре Т2, если известно давление насыщенного пара р1 при температуре Т1 и средняя мольная теплота испарения; 3) среднюю мольную теплоту испарения или возгонки вещества, если известны значения давления насыщенного пара вещества при двух температурах. Применение правила фаз Гиббса к анализу диаграммы
|
||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 269; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.006 с.) |

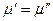 .
.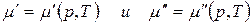 .
. .
.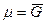 ), то
), то ,
,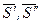 - мольная энтропия компонента в первой и второй фазах соответственно;
- мольная энтропия компонента в первой и второй фазах соответственно; - мольный объем компонента в первой и второй фазах соответственно.
- мольный объем компонента в первой и второй фазах соответственно.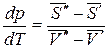 .
. - есть изменение мольной энтропии при переходе вещества из фазы «′» в фазу «″», то есть это энтропия фазового превращения. Тогда
- есть изменение мольной энтропии при переходе вещества из фазы «′» в фазу «″», то есть это энтропия фазового превращения. Тогда
 ,
, – мольная теплота фазового перехода;
– мольная теплота фазового перехода; . (2.6)
. (2.6) и
и  . Следовательно, с повышением давления температура плавления будет увеличиваться. Если ρ т < ρ ж, например, для воды (глицерина или висмута), то
. Следовательно, с повышением давления температура плавления будет увеличиваться. Если ρ т < ρ ж, например, для воды (глицерина или висмута), то 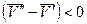 и
и  и с повышением давления температура плавления будет снижаться.
и с повышением давления температура плавления будет снижаться.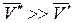 . Если паровую фазу можно считать идеальной, то в соответствии с уравнением Менделеева-Клапейрона
. Если паровую фазу можно считать идеальной, то в соответствии с уравнением Менделеева-Клапейрона ,
, .
. , (2.7)
, (2.7) – среднее значение мольной теплоты фазового перехода в интервале температур от Т 1 до Т 2.
– среднее значение мольной теплоты фазового перехода в интервале температур от Т 1 до Т 2.


