
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Между двумя несмешивающимися жидкостямиСодержание книги
Поиск на нашем сайте
Выразим химический потенциал третьего компонента в обеих жидких фазах через его термодинамическую активность:
Подставим значение химического потенциала:
где Преобразуем:
Так как стандартный химический потенциал зависит только от температуры, в правой части имеем величину, постоянную при Т = const, тогда
где К – коэффициент распределения вещества между несмешивающимися жидкостями. Если количество добавленного третьего компонента мало по сравнению с массами фаз, то термодинамические активности можно заменить концентрациями:
где Уравнение (2.10) выражает известный закон распределения Нернста: отношение равновесных концентраций распределяющегося вещества в двух соприкасающихся, но не смешивающихся растворителях есть величина постоянная при Т = const. Значения К для различных систем приведены в справочной литературе. Если распределяющийся между фазами компонент в какой-либо из фаз подвержен диссоциации или ассоциации, то закон распределения принимает вид:
где n = const – показатель ассоциации.
Закон распределения Нернста является основой для расчета процесса разделения жидких смесей методами жидкостной экстракции. Экстракция – процесс извлечения растворенного вещества (целевого компонента) из раствора с помощью другого растворителя (экстрагента), практически не смешивающегося с первым. Основные цели экстракции: 1. получение чистого растворителя (очистка) 2. концентрирование целевого компонента в аналитических и технологических целях. Движущая сила экстракции – разность химических потенциалов извлекаемого вещества в растворе и экстрагенте. При выборе экстрагента сравнивают значения коэффициента распределения, который определяют экспериментально или берут из справочника. Чем больше К, тем эффективнее экстракция при условии, что в законе распределения фазой (I) является экстрагент. Экспериментально установлено, что лучшее извлечение компонента достигается, если экстракция осуществляется в несколько приемов небольшими порциями экстрагента, чем один раз таким же общим количеством экстрагента. Таким образом, чем больше кратность экстракции, тем эффективнее извлечение целевого компонента. Раздел III. химическое равновесие
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 285; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.160.6 (0.008 с.) |

 Предположим, в стакане находятся две жидкости, практически не смешивающиеся друг с другом, например, бензол и вода. Введем в эту систему третий компонент, например, небольшое количество йода. Добавленное вещество вполне определенным образом распределится между двумя жидкими фазами. При установлении равновесия в соответствии с теоремой Гиббса химические потенциалы распределяющегося вещества (йода) в соприкасающихся фазах (I) и (II) будут равны:
Предположим, в стакане находятся две жидкости, практически не смешивающиеся друг с другом, например, бензол и вода. Введем в эту систему третий компонент, например, небольшое количество йода. Добавленное вещество вполне определенным образом распределится между двумя жидкими фазами. При установлении равновесия в соответствии с теоремой Гиббса химические потенциалы распределяющегося вещества (йода) в соприкасающихся фазах (I) и (II) будут равны: .
. .
. ,
, – термодинамические активности распределяющегося компонента (йода) в обеих фазах.
– термодинамические активности распределяющегося компонента (йода) в обеих фазах. ;
; ;
; .
.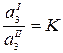
 . (2.10)
. (2.10) – равновесные концентрации распределяющегося вещества в соприкасающихся фазах.
– равновесные концентрации распределяющегося вещества в соприкасающихся фазах. ,
, Для определения К и n уравнение приводят к линейному виду, логарифмируя правую и левую части:
Для определения К и n уравнение приводят к линейному виду, логарифмируя правую и левую части: ;
; ;
; .
.


