
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вывод формул химических соединенийСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте Для установления истинности формулы в задаче могут присутствовать дополнительные сведения различного характера. Чаще всего это молярная масса вещества (в явной или неявной форме) и/или описание превращений, в которые оно вступает. Пример: 12 При сгорании 0,88 г некоторого органического соединения образовалось 0,896 л углекислого газа и 0,72 г воды. Плотность пара данного соединения по водороду 44. Какова истинная формула органического соединения?
Решение:
Прежде всего, уточним, из каких элементов состоит молекула исследуемого вещества. Поскольку в продуктах горения содержится
22,4 л
0,896 л
18 г образуется из 2 г
0,72 г
Выясним, содержится ли в исследуемом веществе кислород. Сложим найденные массы водорода и углерода
Найдем простейшую формулу в виде
Простейшая формула Истинную формулу будем искать в виде
Истинную мольную массу найдем, используя относительную плотность органического соединения по водороду. Относительная плотность одного газа (А) по другому (В) находится по формуле.
следовательно, где 2 – мольная масса водорода, г/моль;
Тогда
n= 88/44=2, следовательно, истинная формула вещества:
(C2H4O)2 или C4H8O2
Пример 13 Задача А. И. Жирова (9-3) IV этап ВОШ по Химии 2004 г. В таблице приведены составы четырех бинарных соединений, имеющих одинаковый качественный состав.
1. Определите качественный состав соединений (А, В). 2. Определите состав соединений I–IV (формулы).
1. Анализ условия задачи В условии сказано, что все соединения состоят из двух одинаковых элементов. Так как I ВxА II ВyА III ВzА IV ВwА Таким образом, А – обязательно неметалл, а В может быть как металлом, так и неметаллом.
2. Нахождение коэффициентов х, у, z, w Для их нахождения воспользуемся законом кратных отношений: «Если два элемента могут образовывать между собой несколько соединений, то массовые доли любого из элементов в этих соединениях отнесённые к массовой доли другого относятся как небольшие целые числа».
Разделим на наибольшее число 13,49, так как в реальных соединениях количество В не одинаковое, а увеличивается от первого соединения к четвертому.
3. Определение атомной массы элемента В Определение элемента В будем производить перебором возможных неметаллов А. Их немного. Это Н, F, имеющие валентность 1, и О, имеющий валентность 2. Остальные неметаллы второго периода не могут образовывать более двух соединений с одним элементом. Рассмотрим одновалентные неметаллы, для них формулы соединений примут вид: I ВА II В0,5А или BА2 III В3/8А или В3А8 IV В1/3А или BА3. Рассчитаем атомную массу элемента В, используя данные для I-го соединения. Если А – «Н», тогда АВ = 13,49·АН = 13,49·1 = 13,49, так как
Такого элемента нет. Если А – «F», тогда АВ = 13,49·19 = 256,31 – такого элемента нет. Рассмотрим двухвалентный неметалл – кислород. Для него формулы соединений примут вид. I В2А II BА III В3А4 IV В2А3, так как для двухвалентного кислорода соединения будут иметь вид В2Аn, отсюда следует, что В2Аn = В2·1/nА. Рассмотрим атомную массу элемента В, исходя из данных для II-го соединения АВ = 6,74·16 = 107,84 – это Ag (серебро). Ответ I Ag2O II AgO III Ag3O4 IV Ag2O3.
Пример 14 Задача (9-1) А. И. Жирова 2004 г. IV этап ВОШ по Химии Минерал муассанит был назван в честь французского химика Анри Муассана. Муассанит обладает высокой химической устойчивостью к большинству химических реагентов и имеет высокий коэффициент преломления. В современных ювелирных изделиях вставки ограненного муассанита заменяют бриллианты. «… Но путем сплавления с едкими щелочами в серебряном тигле переведение в раствор легко удаляется…» (F. Tredwell, «Курс аналитической химии» т. 1, стр. 319, Одесса, 1904.) Навеску 1,000 г тонкоизмельченного муассанита сплавили в серебряном тигле с 7,0 г моногидрата гидроксида натрия. Полученный плав полностью растворили в 50 мл воды. При осторожном добавлении к полученному раствору 30 мл 20%-ного раствора соляной кислоты (плотность 1,1 г/см3) выделилось 0,56 л (н.у.) газа, плотность которого по воздуху составляет 1,52, и выпал белый осадок. Осадок был отделен фильтрованием, промыт дистиллированной водой и прокален при 900 °С. Его масса после прокаливания составила 1,500 г. Весь фильтрат был упарен досуха, масса сухого остатка составила 7,05 г. 1. определите состав муассанита (формула). 2. Напишите уравнение реакции перевода муассанита в растворимое состояние (сплавление с щелочами). Какие газообразные продукты могут выделяться при этой реакции? 3. Почему на Ваш взгляд для сплавления удобнее использовать моногидрат гидроксида натрия? 4. Напишите уравнения реакций, происходящих при добавлении кислоты к анализируемому раствору. 5. Напишите уравнения реакций получения синтетического аналога муассанита в лабораторных условиях.
Решение: 1. Анализ условия задачи Так как минерал муассанит не растворятся при обычных условиях ни в кислотах, ни в щелочах, а перевод его в раствор возможен только после сплавления с щелочью, можно предположить, что он образован либо только из неметаллов, либо из амфотерного металла, образующего катион. Представим химическую формулу минерала АхВу. Схему анализа представим в виде
АхВу + NaOH·H2O → ПЛАВ + Н2О → Раствор без осадка
и газовыделения + HCl → газ
2. Рассчитаем молярную массу и количество выделившегося газа.
Dвозд = 1,52
Газы, имеющие молярную массу 44 г/моль, это СО2, N2O, C3H8, CH3COH. Из этих газов наиболее подходит СО2, так как из щелочных плавов действием HCl можно выделить только СО2.
3. Определим вещество в избытке в реакции плава с раствором HCl.
3.1. Рассчитаем количество молей моногидрата гидроксида натрия
3.2. Рассчитаем количество молей добавленной кислоты
Предположим, что сухой остаток состоит только из NaCl, тогда
как видим При сплавлении минерала со щелочью последняя всегда берется в избытке, иначе сплав полностью не растворится в воде, поэтому элементы, образовавшие минерал перешли в анионы солей натрия. Для образования 0,12 молей NaCl достаточно было 0,12 молей НCl, следовательно, НCl была взята в избытке, поэтому весь углерод, содержащийся в минерале выделился в виде СО2.
4. определение качественного и количественного состава минерала.
В минерале не может быть аниона СО32-, так как карбонаты хорошо растворяются в кислотах, поэтому будем расчет вести по углероду. Предположим, что в анионе минерала один атом углерода, тогда 1 г минерала содержит 0,025 моль соединения
Как видим, Проверим это предположение, получив формулу осадка
Действительно, по реакциям получается SiО2:
SiС + 4 NaOH·H2O = Na2SiO3 + Na2CO3 + 2H2O + 4H2
H2O + Na2SiO3 + 2HCl → 2NaCl + H4SiO4
(n-2)H2O + H4SiO4 → SiО2·nH2O↓
SiО2·nH2O
Na2CO3 + 2HCl → 2NaCl + СО2 + H2O.
7 Стандартные многовариантные задачи 1 Определить молярную массу эквивалента металла, … граммов которого вытесняют из кислоты … водорода, собранного над водой при температуре … °С и добавлении … (Давление насыщенных паров воды см. в приложении). Численные данные для всех вариантов предложены в табл. 1. 2 На окисление … граммов А (…) затрачено … мл (л) кислорода, измеренного при нормальных условиях. Определить молярную массу эквивалента элемента (А), процентный состав образовавшегося оксида, его формулу и с помощью химических реакций показать его кислотно-основной характер. Численные данные для всех вариантов предложены в табл. 2. 3 Определить массу 1 м3 газовой смеси указанного состава при следующих условиях. Численные данные для всех вариантов предложены в табл. 3. 4 Каково содержание основного минерала А в концентрате, если при реакции (…) концентрата с веществом В, выделился газ D объемом (…) (н.у.). Численные данные для всех вариантов предложены в табл. 4. 5 Определить массы и объемы (для газообразных веществ) после завершения реакции (…) вещества А с (…) вещества В (…).Численные данные для всех вариантов предложены в табл. 5. 6 Смесь (…) граммов, состоящую из вещества А и В (…), обработали избытком соляной кислоты. При этом выделилось (…) литров водорода, измеренного при н.у. Определить массовую долю каждого компонента смеси. Численные данные для всех вариантов предложены в табл. 6. 7 При сжигании (…) образовалось (…) воды и (…) углекислого газа (н. у.). Найти истинную формулу органического соединения, если относительная плотность его пара равна (…). Численные данные для всех вариантов предложены в табл. 7. Таблица 1 Численные данные к задаче 1
Таблица 2 Численные данные к задаче 2
Таблица 3 Численные данные к задаче 3
Таблица 4 Численные данные к задаче 4
Таблица 5 Численные данные к задаче 5
Таблица 6 Численные данные к задаче 6
Таблица 7 Цифровые данные к задаче 7
8 Задачи повышенной сложности [3,4] Задачи на смеси 1 На смесь, состоящую из карбида кальция и карбоната кальция, подействовали избытком соляной кислоты, в результате чего были получены смесь газов с плотностью по воздуху 1,27 и раствор, при выпаривании которого образовался твердый остаток массой 55,5 г. Определить массу исходной смеси и массовые доли веществ в ней. 2 На смесь, состоящую из карбида кальция и карбида алюминия, подействовали избытком воды, в результате чего была получена смесь газов с плотностью по аммиаку 1,0. После выпаривания полученного раствора был получен осадок, при прокаливании которого образовался твердый остаток массой 66,8 г. Определите массу исходной смеси и массовые доли веществ ней. 3 При прокаливании смеси массой 41 г, состоящей из ацетата натрия и избытка гидроксида натрия, выделился газ, прореагировавший при освещении с хлором. В результате последней реакции образовалось 11,95 г трихлорметана (хлороформа). Выход хлороформа составил 40 % от теоретического. Найдите массовые доли веществ в исходной смеси. 4 При прокаливании смеси нитратов железа (II) и ртути образовалась газовая смесь, которая на 10 % тяжелее аргона. Во сколько раз уменьшилась масса твердой смеси после прокаливания? 5 При прокаливании смеси нитратов железа (II) и железа (III) образовалась газовая смесь, которая на 9 % тяжелее аргона. Во сколько раз уменьшилась масса твердой смеси после прокаливания? 6 Для растворения 1,26 г сплава магния с алюминием использовано 35 мл раствора серной кислоты (массовая доля 19,6 %, плотность 1,14). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Вычислите массовые доли металлов в сплаве и объем газа (при н.у.), выделившегося при растворения сплава. 7 Образец расплава серебра с медью, массой 3,54 г, плотностью растворен в 23,9 мл раствора азотной кислоты (массовая доля кислоты 31,5 %, плотность раствора 1,17). Для нейтрализации избытка азотной кислоты потребовалось 14,3 мл раствора гидроксида бария с концентрацией 1,4 моль/л. Вычислите массовые доли металлов в сплаве и объем газа (при н.у.), выделившегося при растворении сплава. 8 Смесь железных и цинковых опилок, массой 2,51 г, обработали 30,7 мл раствора серной кислоты (массовая доля кислоты 19,6 %, плотность раствора 1,14). Для нейтрализации избытка кислоты потребовалось 25 мл раствора гидрокарбоната калия с концентрацией 2,4 моль/л. Вычислите массовые доли металлов в исходной смеси и объем газа (при н.у.), выделившегося при растворении металлов. 9 Смесь сульфата бария и углерода, массой 30 г, прокалили без доступа кислорода при температуре 1 200 °С. Полученный после прокаливания продукт обработали избытком соляной кислоты. Масса нерастворившегося осадка составила 1,9 г. Запишите уравнения соответствующих реакций и определите массовые доли веществ в исходной смеси. 10 Рассчитайте массовые доли компонентов смеси, состоящей из гидрокарбоаната аммония, карбоната кальция и гирфосфата аммония, если известно, что из 62,2 г этой смеси получили 17,6 г оксида углерода (IV) и 10,2 г газообразного аммиака.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 721; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 и
и 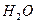 , то сделаем вывод, что сгоревшее вещество содержит углерод и водород. Найдем их количество.
, то сделаем вывод, что сгоревшее вещество содержит углерод и водород. Найдем их количество.
 —―
—― 
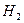

 = 0,88 г. Так как
= 0,88 г. Так как 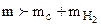 , то вещество содержит кислород
, то вещество содержит кислород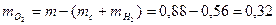 г.
г.


 .
. .
. .
. г/моль.
г/моль. ,
,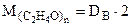 ,
, - относительная плотность органического соединения по водороду.
- относительная плотность органического соединения по водороду. = 44·2=88 г/моль
= 44·2=88 г/моль

 , можно предположить, что
, можно предположить, что 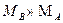 , следовательно, А скорее всего неметалл, находящийся во 2-ом периоде, либо – водород, поэтому их формулы можно представить в виде:
, следовательно, А скорее всего неметалл, находящийся во 2-ом периоде, либо – водород, поэтому их формулы можно представить в виде:

 .
. или
или .
.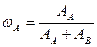 ,
,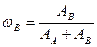 ,
,

 .
.


 осадок + раствор
осадок + раствор  прокаленный осадок + сухой остаток
прокаленный осадок + сухой остаток

 Мгаза = 1,52·29 = 44,08 г/моль
Мгаза = 1,52·29 = 44,08 г/моль .
.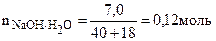 .
. .
. .
. ,
, =
=  , отсюда следует, что весь сухой остаток состоит только из NaCl, следовательно, элементы, образовавшие минерал перешли в газ СО2 и осадок.
, отсюда следует, что весь сухой остаток состоит только из NaCl, следовательно, элементы, образовавшие минерал перешли в газ СО2 и осадок. .
.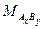 <
<  , что еще раз подтверждает, что минерал не относится к классу карбонатов. При такой маленькой молярной массе, анионом может быть только С4-, тогда х·МА = 40–12 = 28. Если х = 1, тогда А – Si, если х = 2,
, что еще раз подтверждает, что минерал не относится к классу карбонатов. При такой маленькой молярной массе, анионом может быть только С4-, тогда х·МА = 40–12 = 28. Если х = 1, тогда А – Si, если х = 2, - это SiО2.
- это SiО2. = 1,52
= 1,52
 = 23
= 23
 = 0,96
= 0,96
 = 3,14
= 3,14
 = 1,81
= 1,81



