
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стехиометрические соотношенияСодержание книги Поиск на нашем сайте
Для каждого вещества реакции существуют следующие количества вещества:
Так как количество вещества не может быть отрицательно, то для исходных веществ
Для продуктов реакции
Стехиометрические соотношения – соотношения между количествами, массами или объемами (для газов) реагирующих веществ или продуктов реакции, рассчитанные на основе уравнения реакции. В основе расчетов по уравнениям реакций лежит основной закон стехиометрии: отношение количеств реагирующих или образовавшихся веществ (в молях) равно отношению соответствующих коэффициентов в уравнении реакции (стехиометрических коэффициентов).
Пример: Для реакции алюмотермии, описываемой уравнением: 3Fe3O4 + 8Al = 4Al2O3 + 9Fe, количества прореагировавших веществ и продуктов реакции относятся как
Для расчетов удобнее применять другую формулировку этого закона: отношение количества прореагировавшего или образовавшегося вещества в результате реакции к своему стехиометрическому коэффициенту - есть константа для данной реакции. В общем случае для реакции вида а А + b B = c C + d D, где маленькие буквы обозначают коэффициенты, а большие – химические вещества, количества реагирующих веществ связаны соотношением:
Любые два члена этого соотношения, связанные равенством, образуют пропорцию химической реакции: например, Если для реакции известна масса образовавшегося или прореагировавшего вещества реакции, то можно найти его количество по формуле Если даны массы нескольких реагентов, то расчет масс остальных веществ ведут по тому из веществ, которое находится в недостатке, т. е. полностью расходуется в реакции. Количества веществ, которые точно соответствуют уравнению реакции без избытка или недостатка, называют стехиометрическими количествами. Таким образом, в задачах, связанных со стехиометрическими расчетами, основным действием является нахождение опорного вещества и расчет его количества, которое вступило или образовалось в результате реакции.
Расчет количества индивидуального твердого
где
Расчет количества природного минерала Пусть дан природный минерал пирит, основной компонент которого FeS2. Кроме него в состав пирита входят примеси. Содержание основного компонента или примесей указывается в массовых процентах, например,
Если известно содержание основного компонента, то
Если известно содержание примесей, то
где
Аналогично рассчитывается количество компонента в смеси твердых веществ, если известно его содержание в массовых долях.
|
||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 1317; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.47.139 (0.008 с.) |

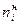 - начальное количество i -го вещества (количество вещества до начала реакции);
- начальное количество i -го вещества (количество вещества до начала реакции);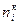 - конечное количество i -го вещества (количество вещества по окончании реакции);
- конечное количество i -го вещества (количество вещества по окончании реакции);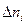 - количество прореагировавшего (для исходных веществ) или образовавшегося вещества (для продуктов реакции).
- количество прореагировавшего (для исходных веществ) или образовавшегося вещества (для продуктов реакции).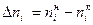 , так как
, так как 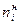 >
>  .
. .
. .
. или
или 
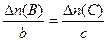 или
или  и т. д.
и т. д.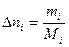 , а затем, используя пропорцию химической реакции, можно найти
, а затем, используя пропорцию химической реакции, можно найти 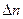 для остальных веществ реакции. Вещество, по массе или количеству которого находят массы, количества или объемы других участников реакции, иногда называют опорным веществом.
для остальных веществ реакции. Вещество, по массе или количеству которого находят массы, количества или объемы других участников реакции, иногда называют опорным веществом.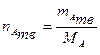 ,
,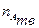 - количество индивидуального твердого вещества А;
- количество индивидуального твердого вещества А;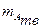 - масса индивидуального твердого вещества А, г;
- масса индивидуального твердого вещества А, г;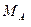 - молярная масса вещества А, г/моль.
- молярная масса вещества А, г/моль.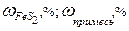 .
. .
.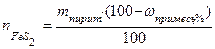 ,
,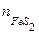 - количество индивидуального вещества FeS2, моль;
- количество индивидуального вещества FeS2, моль; - масса минерала пирита, г.
- масса минерала пирита, г.


