
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задачи на использование величины «Выход реакций»Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Под выходом реакции
где
Пример 5: Каков выход реакции, если при окислении кислородом 4,8 г магния получено 0,16 моль оксида.
Решение: 1 Записать уравнение реакции
2 Рассчитать количество веществ, данных в условии.
3 Определить теоретическое количество оксида магния по пропорции химической реакции из предположения, что весь магний окислился.
4 Определить выход реакции
Пример 6: [1] Определите содержание примеси оксида кадмия в массовых процентах в минерале хаулеите CdS, если при окислении
Решение: 1 Записать уравнение реакции
2 Определить количество образовавшегося SO2
3 Рассчитать количество CdS, которые необходимо окислить для получения 0,036 моль SO2. Воспользуемся пропорцией химической реакции.
4 Определить массу CdS в минерале
5 Определить массу примеси CdО в минерале
6 Определить содержание примеси
Для обратимых процессов часто используется понятие степени превращения одного из реагентов. Степень превращения (Ri) – отношение количества прореагировавшего вещества к общему количеству указанного вещества до начала реакции
где
Пример 7: [1] Из метана в условиях дугового разряда образуется ацетилен. Вычислите степень превращения метана, если полученная газовая смесь содержит 20 % ацетилена по объему. Побочными процессами пренебречь.
Решение: 1 Записать уравнение реакции
2 Записать формулу для расчета объемной доли ацетилена в конечной смеси, учитывая, что для газовых смесей объемная доля равна максимальной доле.
Из условия задачи известно, что начальная газовая фаза состояла на 100 % из СН4, следовательно,
Все величины 3 Выразить через х все Записать пропорцию химической реакции
4 Рассчитать конечное количество метана
5 Подставить полученные величины в уравнение для расчета
6 Рассчитать степень превращения
В случае, если протекает несколько реакций, выход которых отличен от теоретического, то чтобы найти суммарный выход указанной последовательности реакций, достаточно перемножить выходы каждой стадии, выраженные в долях.
Задачи на определение вещества, Пример 8: Определить массы образовавшихся веществ и веществ оставшихся неизрасходованными после завершения реакции карбоната натрия массой 53,0 г с раствором соляной кислоты массой 200,0 г и концентрацией 20,250%. Дополнительно рассчитать объём выделившегося углекислого газа, если Р=730 мм рт. ст. а t= 10 °С (растворимостью СО2 в растворе пренебречь) Проверить выполнение закона сохранения массы веществ (закон Ломоносова) составлением материального баланса.
Решение: Записать уравнение реакции
Для решения этой задачи необходимо определить число моль каждого из исходных веществ. Так как масса второго вещества не дана, то найдем ее
Найти количество каждого вещества по формуле
Предположим, что оба вещества взяты в стехиометрических количествах, тогда
Необходимо проверить правильность предположения, составив пропорцию химической реакции
Подставить полученные значения в пропорцию
следовательно, предположение неверно. HCl взяли с избытком, а
Определить массу HCl, оставшегося после реакции
где
Найти массу оставшегося HCl
Определить количество образовавшегося СО2
Так как по условию задачи в исходных веществах СО2 не было, то Определить
Так как давление дано в мм рт.ст., то удобно использовать
Определить массу образовавшегося СО2
Определить количество Н2О, образовавшегося в ходе реакции
Найти массу образовавшейся воды
Так как в реакции использовался водный раствор HCl, то масса воды после реакции составит
где
тогда Определить количество образовавшегося NaCl в ходе реакции
Так как по условию задачи в исходных веществах NaCl не было, то
Масса NaCl
Проверить правильность решения задачи можно с помощью материального баланса, который иллюстрирует закон Ломоносова.
Материальный баланс
Невязка баланса составит
Невязка баланса (в долях) не должна быть больше точности округления. В данном случае точность округления 0,001, невязка баланса 6·10-5.При отсутствии в расчётах округления в соответствии с законом Ломоносова невязка равна 0. Большая величина невязки свидетельствует об ошибке в расчётах.
Задачи, в которых участвуют сплавы или смеси веществ При решении таких задач необходимо придерживаться следующих рекомендаций. I Написать уравнения реакций всех компонентов смеси, особо отметить компоненты, которые не вступают в реакцию. II Все расчеты рекомендуется проводить, используя мольные величины. III Если условия задачи сформулировать таким образом, что расчет можно вести более чем по одному реагенту, то необходимо проверить, не находится ли одно из веществ в избытке.
Пример 9: На сплав меди и цинка массой 2,5 г подействовали избытком раствора соляной кислоты. Выделилось 0,224 литра водорода (н.у.). Определить состав сплава в массовых процентах.
Решение: 1 Записать реакции взаимодействия компонентов сплава с соляной кислотой.
2 Определить количество выделившегося водорода
3 Используя пропорцию химической реакции, рассчитать количество прореагировавшего цинка.
По условию задачи сказано, что кислота взята в избытке, значит
4 Определим массу цинка в сплаве.
5 определить состав сплава.
Пример 10: Сплав алюминия и лития массой 2,770 г растворили в избытке соляной кислоты. При этом выделилось 3,472 л водорода (н.у.). Определить состав сплава в массовых долях.
Решение: 1 Записать уравнения реакций всех компонентов сплава с соляной кислотой
Как видим из уравнений реакций объем выделившегося водорода зависит от количества вещества в сплаве как алюминия, так и лития, поэтому примем количество вещества алюминия за х молей, а лития – у молей. 2 Выразить через х и у массу сплава.
3 Выразить через х и у количество выделившегося водорода.
Согласно пропорции химической реакции взаимодействия алюминия с соляной кислотой
Согласно пропорции химической реакции взаимодействия лития с соляной кислотой
Общее количество водорода, выделившегося при растворении сплава, складывается из количеств вещества водорода, которые образовались в реакции взаимодействия соляной кислоты с каждым из компонентов сплава
4 Составить и решить систему уравнений
5 Определить массы компонентов сплава
6 Рассчитать состав сплава
Пример 11: [2] Образец смеси нитратов свинца (II) и ртути (II) прокалили. Плотность по водороду образовавшейся газовой смеси 21,5. Во сколько раз уменьшилась масса образца?
Решение: 1 Записать реакции, происходящие с компонентами смеси
Твердый остаток составляют PbО и Hg, а газовую смесь образуют NO2 и О2, выделяющиеся по обоим реакциям. 2 Пусть количество вещества 3 Выразить количества вещества продуктов через х и у, используя пропорцию химической реакции.
По условию задачи
Для второй реакции
4 Определить молярную массу газовой смеси
5 Выразить
6 Выразить через х и у массу исходной смеси
7 Выразить через х и у массу остатка
8 Интересующее нас соотношение будет
Подставить значение х из пятого действия х = 10у.
Масса смеси уменьшится в полтора раза.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 528; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.232.108 (0.009 с.) |

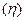 (выход реакции от теоретического) понимают отношение количества реально полученного вещества к количеству вещества, которое теоретически можно получить в данной реакции (рассчитанному по уравнению реакции). Вместо количества вещества можно использовать массы веществ, или объемы для газообразных веществ. Выход реакции может быть выражен как в процентах и в долях.
(выход реакции от теоретического) понимают отношение количества реально полученного вещества к количеству вещества, которое теоретически можно получить в данной реакции (рассчитанному по уравнению реакции). Вместо количества вещества можно использовать массы веществ, или объемы для газообразных веществ. Выход реакции может быть выражен как в процентах и в долях. ,
,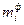 ,
, 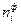 - реально образующаяся (фактическая) масса или количество вещества;
- реально образующаяся (фактическая) масса или количество вещества; ,
, 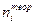 - теоретически возможная масса и количество вещества i, рассчитанные по стехиометрии.
- теоретически возможная масса и количество вещества i, рассчитанные по стехиометрии.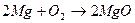 .
.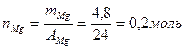 ,
,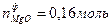 - из условия.
- из условия.
 .
.
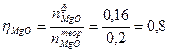 .
.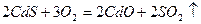 .
.
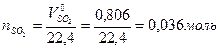 .
.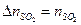 , так как SO2 продукт, а по условию задачи не сказано, что SO2 был в системе до реакции.
, так как SO2 продукт, а по условию задачи не сказано, что SO2 был в системе до реакции.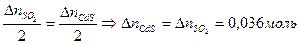 .
.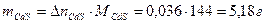 .
.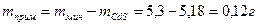 .
.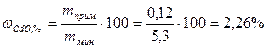 .
.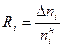 ,
,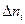 - количество прореагировавшего вещества i;
- количество прореагировавшего вещества i;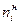 - начальное количество вещества i.
- начальное количество вещества i.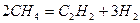 .
. .
.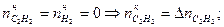
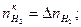
 .
.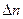 связаны между собой пропорцией химической реакцией, поэтому достаточно выразить
связаны между собой пропорцией химической реакцией, поэтому достаточно выразить 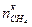 присутствует неизвестная величина
присутствует неизвестная величина 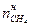 . Обозначим
. Обозначим 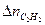 = х.
= х. ,
,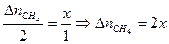 ,
,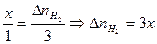 .
.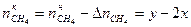 .
.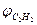
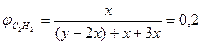 ,
,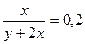 ,
, ,
,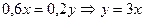 .
.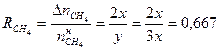 .
.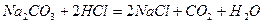 .
.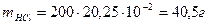 .
.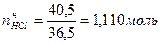 ,
, .
.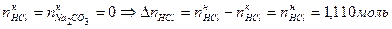 ,
,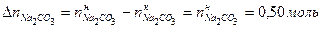 .
. .
.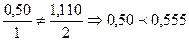 ,
, прореагировал полностью, т. е.
прореагировал полностью, т. е.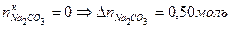 ,
, 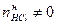 .
. ,
,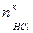 - избыток HCl, моль.
- избыток HCl, моль. находим из пропорции
находим из пропорции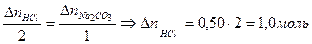 ,
, .
.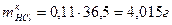 .
.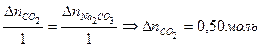 .
.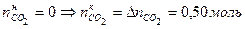 .
.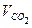
 ,
,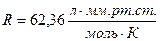 , тогда переводя температуру в градусы Кельвина получим
, тогда переводя температуру в градусы Кельвина получим .
.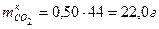 .
.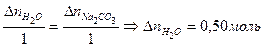 .
.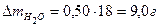 .
.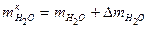 ,
,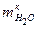 - масса воды после реакции, г;
- масса воды после реакции, г; - масса воды в растворе HCl, г.
- масса воды в растворе HCl, г.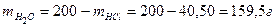 ,
, .
. .
. .
.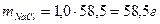 .
.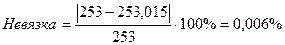 .
. ,
, реакция не пойдет, так как с неокислительными кислотами могут реагировать только металлы, стоящие в ряду напряжений до водорода.
реакция не пойдет, так как с неокислительными кислотами могут реагировать только металлы, стоящие в ряду напряжений до водорода. .
. , так как по условию задачи водорода до реакции в системе не было, то
, так как по условию задачи водорода до реакции в системе не было, то 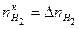 .
.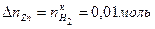 .
.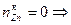
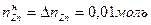 .
. .
.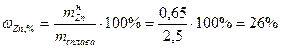 .
. .
.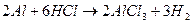 ,
,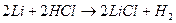 .
.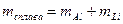 ,
, ,
, ,
,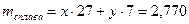 .
. .
.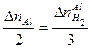 .
. моль, так как по условию задачи кислота взята в избытке и сплав полностью прореагировал, тогда
моль, так как по условию задачи кислота взята в избытке и сплав полностью прореагировал, тогда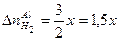 моль.
моль. .
.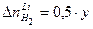 моль
моль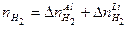 ,
,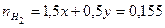 .
.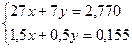
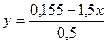 ,
, 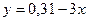
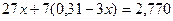 ,
, ,
,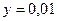 .
.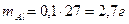 ,
,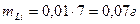 .
.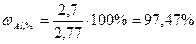 ,
, .
.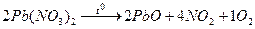 ,
,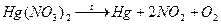 .
.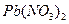 в смеси - х молей, а
в смеси - х молей, а  - у молей.
- у молей.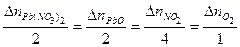 .
.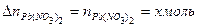 .
.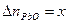 моль,
моль,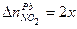 моль,
моль, моль.
моль. ,
, моль,
моль, ,
, ,
,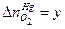 .
.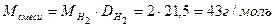 .
.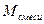 через х и у.
через х и у.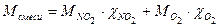 ,
,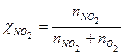 ,
, .
.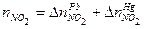 ,
,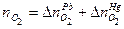 ,
,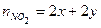 ,
,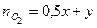 .
.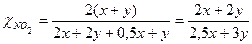 ,
,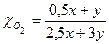 .
.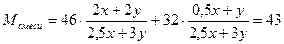 ,
, ,
,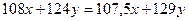 ,
, .
. ,
,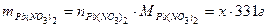 ,
,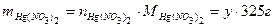 ,
,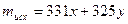 .
.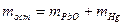 ,
,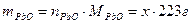 ,
, ,
,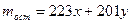 .
.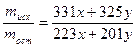 .
.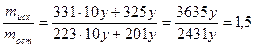 .
.


