Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Газообразное состояние вещества. Газовые законы. Химический состав атмосферного воздуха.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Газообразное состояние вещества. Газовые законы. Химический состав атмосферного воздуха. Газ — агрегатное состояние вещества, в котором его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Газообразное состояние вещества является самым распространенным состоянием вещества Вселенной. Солнце, звезды, облака межзвездного вещества, туманности, атмосферы планет состоят из газов, или нейтральных, или ионизованных (плазмы). Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку. Плотность газов при нормальном давлении на несколько порядков меньше плотности жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно зависит от давления и температуры. Свойства большинства газов — прозрачность, бесцветность и легкость — затрудняло их изучение, поэтому физика и химия газов развивались медленно. Только в 17 в. было доказано, что воздух обладает весом (Э. Торричелли и Б. Паскаль). Наиболее полно изучены были свойства достаточно разряженных газов, в которых расстояния между молекулами при нормальных условиях порядка 10 нм, что значительно больше радиуса действия сил межмолекулярного взаимодействия. Такой газ, молекулы которого рассматриваются как невзаимодействующие материальные точки, называется идеальным газом. Идеальные газы строго подчиняются законам Бойля — Мариотта и Гей-Люссака. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах. Уравнение состояния идеального газа было получено Б. Клапейроном и обобщено Д. И. Менделеевым для любой массы газа. где R универсальная газовая постоянная = 8,31 Дж/моль*К Электрические свойства газов определяются возможностью ионизации молекул или атомов, т. е. появлением в газе электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность газов увеличивается. При температурах выше нескольких тысяч К газ частично ионизуется и превращается в плазму. По магнитным свойствам газы делятся на диамагнитные (инертные газы, СО2, Н2О) и парамагнитные (О2). Молекулы диамагнитных газов не имеют постоянного магнитного момента и приобретают его лишь под действием магнитного поля. Те газы, молекулы которых обладают постоянным магнитным моментом, ведут себя как парамагнетики. Газоые законы - это количественные зависимостти между двумя параметрами газа при фиксированном значении третьего параметра. P, V, T Изопроцессы - это процессы протекающие при неизменном значении одного из параметров. Уникальность воды Плотность Как известно, при охлаждении все вещества сжимаются. Вода следует этому правилу до тех пор, пока ее температура не достигнет значения 4° С. В этом состоянии она обладает наибольшей плотностью. При дальнейшем понижении температуры, вода, вопреки общему правилу, начинает расширяться, а переход в твердое состояние сопровождается еще одним скачкообразным расширением. Благодаря этому лед плавает, а водоемы не промерзают. Лёд(900 кг/) Вода (1000 кг/) Теплоемкость Вода обладает способностью поглощать большое количество теплоты и сравнительно мало при этом нагреваться. Удельная теплоемкость воды (4200 Дж/кг*С') выше, чем у большинства веществ, она в 10 раз выше чем у железа. Больших затрат энергии требуют процессы испарения и замерзания, которые происходят при неизменности температуры. Именно по этим причинам дневные и годовые колебания температуры не такие резкие, а в системах отопления и охлаждения используют воду. Поверхностное натяжение У воды огромная сила поверхностного натяжения. Поверхностное натяжение является необходимым условием для капиллярных процессов – основы жизнедеятельность животных и растений, химических технологий и бытовых явлений. Полотенце, белье, рыхление почвы используют этот эффект. Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными. Тройная точка воды Тройная точка определяется значением температуры и давления, при котором вещество может одновременно и равновесно находится в трех агрегатных состояниях — твердом, жидком и газообразном. Критическая точка Критическая точка – сочетание значений температуры и давления, при которых исчезает различие в свойствах жидкой и газообразной фаз вещества. Критическая точка для воды достигается с большим трудом при температуре 374,2° С и давлении 21,4 МПа. В момент достижения критической точки вода характеризуется крайне низкой вязкостью, непрозрачностью, резким падением скорости распространения звуковых волн и в три раза более низкой плотностью, чем при обычных условиях. Сверхкритическое состояние представляют собой нечто среднее между жидкостью и газом. Вода в сверхкритическом состоянии может сжиматься, как газ, и в тоже время, способна растворять твердые вещества, что не характерно для газов. Энергия воды Механическое движение воды – источник энергии речных и приливных электростанций. Для получения электроэнергии используют и разность температур между поверхностными и глубинными слоями воды. Вода – основа экологически чистой водородной энергетики, а тяжелая вода используется в термоядерной энергетике. Очень тщательно очищенная и освобожденная от газов вода приобретает совершеннонеобычные свойства: ее можно перегреть на десятки градусов выше точки кипения —она не закипит, ее можно очень сильно переохладить — она не замерзнет! Память воды Вода способна к объединению большого числа своих молекул в кластеры и цепочки. Такая "полимеризованная" вода кипит при температуре на несколько градусов выше, чем обычная и имеет ряд совершенно новых физических свойств. Кластеры представляют собой стабильные долгоживущие кристаллоподобные образования. Их конфигурация реагирует перестройкой даже на незначительные внешнее воздействия и примеси.За счет различия в продолжительности жизни водных кластеров большинство взаимодействий приводит не к полной, а лишь к частичной реорганизации кластеров, что обеспечивает воде как короткую, так и достаточно долговременную память. Для получения структурированной воды используют различные технологии: омагничивание, замораживание с последующим таянием, электролитическое разделение воды на "мертвую" и "живую". Аномальные причины температура плавления и кипения воды Самое удивительное и благостное для живой природы свойство воды - это ее способность при "нормальных" условиях быть жидкостью. Молекулы очень похожих на воду соединений (например, молекулы H2S или H2Se) намного тяжелее, а образуют при тех же условиях газ.Объясняется это довольно просто - большая часть молекул воды соединена водородными связями. Именно этими связями отличается вода от жидких гидридов H2S, H2Se и H2Te. Если бы их не было, то вода кипела бы уже при минус 95 °C. Энергия водородных связей достаточно велика, и разорвать их можно лишь при значительно более высокой температуре. Они обусловлены силами притяжения между несущим частичный отрицательный заряд атомом кислорода одной молекулы и несущим частичный положительный заряд атомом водорода другой молекулы. Полностью водородные связи исчезают только при температуре водяного пара 600 °C. Необычайно велики пределы допустимых значении переохлаждения и перегрева воды - при аккуратном нагревании или охлаждении вода остается жидкой от -40 °C до +200 °C. Тем самым температурный диапазон, в котором вода может оставаться жидкой, расширяется до 240 °C. При нагревании льда сначала температура его повышается, но с момента образования смеси воды со льдом температура будет оставаться неизменной до того момента, пока не расплавится весь лёд. Это объясняется тем, что тепло, подводимое к тающему льду, прежде всего расходуется только на разрушение кристаллов. Температура тающего льда остаётся неизменной до тех пор, пока не произойдёт разрушение всех кристаллов В кристаллах льда также существуют водородные связи. Но здесь система таких связей статична, а следовательно, еще более прочна, чем в жидкой воде. В этом причина аномально высокой температуры плавления и удельной теплоты плавления льда. Общие физические свойства Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа"). - Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au,Ag,Cu,Sn,Pb,Zn,Fe уменьшается. - Блеск обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света. - Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду Ag,Cu,Al,Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа". - Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути. - Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом. - Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3). - Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -390C), самый тугоплавкий металл – вольфрам (t0пл. = 33900C). Металлы с t0пл. выше 10000C считаются тугоплавкими, ниже – низкоплавкими. К основным механическим свойствам металлов относятся прочность, вязкость, пластичность, твердость, выносливость, ползучесть, износостойкость. Они являются главными характеристиками металла. Под прочностью материала понимают его способность сопротивляться деформации или разрушению под действием статических или динамических нагрузок. О прочности судят по характеристикам механических свойств, которые получают при механических испытаниях. К статическим испытаниям на прочность относятся растяжение, сжатие, изгиб, кручение, вдавливание. К динамическим относятся испытания на ударную вязкость, выносливость и износостойкость. Эластичностью называется способность материалов упруго деформироваться, а пластичностью — способность пластически деформироваться без разрушения. Вязкость — это свойство материала, которое определяет его способность к поглощению механической энергии при постепенном увеличении пластической деформации вплоть до разрушения материала. Материалы должны быть одновременно прочными и пластичными. Твердость — это способность материала сопротивляться проникновению в него других тел. Выносливость — это способность материала выдерживать, не разрушаясь, большое число повторно-переменных нагрузок. Износостойкость — это способность материала сопротивляться поверхностному разрушению под действием внешнего трения. Ползучесть — это способность материала медленно и непрерывно пластически деформироваться (ползти) при постоянном напряжении (особенно при высоких температурах). Кратные связи
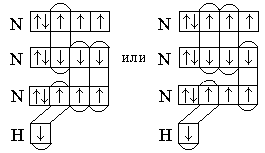
Метод наложения валентных схем. Делокализованная Рассмотрим метод наложения валентных схем на примере азидоводорода HN3. В молекуле HN3 атомы азота связаны друг с другом, а с водородом соединён один из них.
Центральный атом азота может быть трёхвалентным за счет неспаренных электронов, но в обоих случаях в молекуле остаются два неспаренных электрона, что делает схемы маловероятными. Перенесем один из s-электронов центрального атома на “верхний” атом азота:
Равновероятная схема получится, если переместим один из s -электронов центрального атома на другой атом азота:
Термохимические расчеты Различают экзо- и эндотермические реакции. Химические реакции, сопровождающиеся выделением или поглощением энергии в форме теплоты, называются соответственно экзотермическими и эндотермическими реакциями. Энтальпия реакции равна количеству энергии в форме теплоты, выделяющейся или поглощающейся в результате химического процесса при постоянных р = 1 атм и температуре Т. Энтальпия образования сложного вещества есть энтальпия реакции синтеза его из простых веществ, взятых в наиболее устойчивых физических состояниях при заданном внешнем давлении р = 1 атм и температуре Т. Под простыми веществами подразумеваются все химические элементы периодической системы в кристаллической форме, характерной для металлов (за исключением ртути), и молекулярной форме для неметаллов (за исключением благородных газов) в том агрегатном состоянии, которое для них характерно при внешнем давлении 1 атм. Энтальпия образования всех простых веществ принята за начало отсчета и равна нулю. Задачей термохимии является расчет энтальпий химических реакций по табличным значениям, опираясь на закон Гесса. Основной закон термохимии (закон Гесса, 1836 г.) в современной интерпретации утверждает, что энтальпия реакций, протекающих либо при V,T = const, либо p,T = const не зависти от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. Закон Гесса: тепловой эффект реакции, протекающей при постоянном давлении и (или) объеме, зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции Следствие из закона Гесса: энтальпия химических реакций равна сумме энтальпий образования продуктов реакций за вычетом суммы энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов. Поскольку D H есть функция состояния системы, в которой происходят реакции, то в соответствии с законом Гесса независимо от того, идет реакция по первому или второму пути: D H 1 = D H 2 + D H 3 или Именно столько энергии выделяется (экзотермический процесс) при образовании 1 моль СО из С(гр) и 1/2О2(г). Эта величина вычислена теоретически. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Пример. Реакция синтеза аммиака является обратимой:
В состоянии равновесия скорости прямой и обратной реакции становятся равными. Закон Рауля Исследования растворов, выполненные французским физиком и химиком Ф. Раулем, позволили установить следующий закон, носящий его имя: давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя. р 1 = р 1 0 N 1, где р 1 и р 1 0 – давление пара растворителя над раствором и чистым растворителем; N 1 – мольная доля растворителя в растворе. Линейная зависимость давления пара растворителя над раствором в координатах р – N 1 представлена на рис. 29. . Зависимость парциального давления пара р 1 растворителя от мольной доли N 1 растворителя в растворе Закон Рауля выполняется лишь для идеальных растворов. Идеальный раствор состоит из компонентов, энергия взаимодействия между которыми одинаковая и не зависит от природы входящих в состав раствора веществ. Следствием идеальности раствора является характер зависимости между парциальным давлением пара компонента и его концентрацией в растворе. Изменение концентрации компонента в растворе приведет к пропорциональному изменению его парциального давления над раствором, т.е. давление пара растворителя (р 1) над раствором, содержащим нелетучее вещество, линейно изменяется с ростом мольной доли растворителя (рис. 29). В реальных растворах наблюдаются значительные отклонения от закона Рауля. Например, такие отклонения можно наблюдать для водного раствора тростникового сахара (рис. 30). Пунктирная прямая на рис. 30 относится к идеальному раствору, подчиняющемуся закону Рауля. Зависимость давления пара от мольной доли растворителя для неидеального раствора (в данном случае раствора тростникового сахара) представлена непрерывной кривой, и показывает отклонение от закона Рауля. Осмотическое давление. Закон Вант-Гоффа Осмос (др.-греч. wsmoV толчок, давление) есть явление самопроизвольного перехода молекул растворителя из более разбавленного в менее разбавленный раствор. Это явление наблюдается в том случае, когда оба раствора отделены друг от друга полупроницаемой перегородкой, пропускающей только растворитель (рис. 32). В левом сосуде (рис. 32) полупроницаемой перегородкой разделены раствор соли в воде и чистая вода. В термодинамически неравновесной системе происходит самопроизвольный процесс выравнивания концентраций путем проникновения молекул воды через полупроницаемую перегородку в концентрированный раствор соли. Преградой такому движению растворителя служит увеличивающееся давление столба жидкости, как показано в правом сосуде на рис. 32. Процесс выравнивания концентраций останавливается при достижении некоторого давления p. Перепад уровней между раствором и чистым растворителем в правом колене отражает осмотическое давление воды p. К осмотическому давлению применимы законы газового состояния: p V = nRT или p = сRT, где V – объем раствора, n – количество моль растворенного вещества, R – газовая постоянная, Т – абсолютная температура. Последнее уравнение называется законом Вант-Гоффа. Явление осмоса играет важную роль в жизни растений и живых организмов. У млекопитающих осмотическое давление большинства биологических жидкостей равно осмотическому давлению крови. Осмотическое давление, создаваемое в клетках животных растворами белков, полисахаридов и др., незначительно, но играет важную роль в обмене веществ. Свойства, зависящие от количества составляющих раствора, а не от природы его частиц, называют коллигативными свойствами растворов. Законы Рауля р1 = р10N1; Генри с = к г. р; Вант-Гоффа p = сRT; а также повышение температуры кипения и понижение температуры замерзания водного раствора нелетучего вещества DТ кип. = Э×сm, и DТ кр. = Ксm отражают проявление растворами коллигативных свойств. 0 Реакции гидролиза Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катионы или анионы соли при взаимодействии с водой образуют слабый электролит, то среда раствора становится либо щелочной, либо кислой. Гидролизом называют реакцию ионов солей с водой, изменяющую рН среды с электронейтральной на кислую или щелочную. а) Гидролиз соли, образованной слабой кислотой и сильным основанием: СН3СООNa(р-р) + Н2О(ж) ⇄ СН3СООН(р-р) +NaOH(р-р) Полное ионное уравнение: СН3СОО-(р-р)+Na+(р)+Н2О(ж)⇄СН3СООН(р-р)+Na+(р-р)+ОН- Соли, образованные слабыми кислотами и сильными основаниями, гидролизуются с образованием ионов гидроксида ОН-, среда становится щелочной (рН > 7). б) Гидролиз соли, образованной сильной кислотой и слабым основанием: NH4Cl(р-р) + H2O(ж) ⇄ HCl(р-р) + NH4OH(р-р) Полное ионное уравнение: NH4+(р-р)+Cl-(р-р)+H2O(ж) ⇄ H+(р-р) + Cl-(р-р) + NH4OH(р-р) Соли, образованные сильными кислотами и слабыми основаниями, гидролизуются с образованием ионов водорода Н+, среда становится кислой (pH < 7). Заметим, что соли, образованные сильными кислотами и сильными основаниями, например такие, как NaCl, не гидролизуются и не изменяют рН раствора (рН = 7). Легко происходит гидролиз солей, образованных слабыми кислотами и слабыми основаниями. В зависимости от относительной силы кислоты или основания будет меняться кислотность водного раствора. Реакции осаждения (образование нерастворимой соли) СаСl2(р-р) + Na2SO4(р-р) ® 2NaCl(р-р) + CaSO4(т)¯ Полное ионное уравнение: Ca2+(р-р)+2Сl-(р)+2Na+(р-р)+SO4(р-р)®2Na+(р-р)+2Cl-(р-р)+CaSO4(т)¯ Ионное уравнение в сокращенном виде: Ca2+(р-р)+ SO4(р-р)® CaSO4(т)¯ Грубодисперсные системы. Эти системы содержат в качестве дисперсной фазы наиболее крупные частицы диаметром от 0,1 мк и выше. К этим системам относятся суспензии и эмульсии. Суспензиями называют системы, в которых твёрдое вещество находится в жидкой дисперсионной среде, например, взвесь крахмала, глины и др. в воде. Эмульсиями называют дисперсионные системы двух несмешивающихся жидкостей, где капельки одной жидкости во взвешенном состоянии распределены в объёме другой жидкости. Например, масло, бензол, толуол в воде или капельки жира (диаметром от 0,1 до 22 мк) в молоке и др. Коллоидные системы. Они имеют размеры частиц дисперсной фазы от 0,1 мк до 1 ммк (или от 10-5 до 10-7 см). Такие частицы могут проходить через поры фильтровальной бумаги, но не проникают через поры животных и растительных мембран. Коллоидные частицы при наличии у них электрического заряда и сольватно-ионных оболочек остаются во взвешенном состоянии и без изменения условий очень долго могут не выпадать в осадок. Примерами коллоидных систем могут служить растворы альбумина, желатина, гуммиарабика, коллоидные растворы золота, серебра, сернистого мышьяка и др. Молекулярно-дисперсные системы. Такие системы имеют размеры частиц, не превышающие 1ммк. К молекулярно-дисперсным системам относятся истинные растворы неэлектролитов. Ионно-дисперсные системы. Это растворы различных электролитов, как, например, солей, оснований и т.д., распадающихся на соответствующие ионы, размеры которых весьма малы и выходят далеко за пределы Высокодисперсные системы называют коллоидными растворами или золями. Золь – высокодисперсная система с жидкой, газообразной или твердой дисперсионной средой и размером частиц дисперсной фазы 10-7 – 10-9 м, т.е. в 10 – 1000 раз больше, чем размеры атомов, молекул или ионов, если принять во внимание расчет, приведенный выше. Если дисперсионной средой является газ, например воздух, дисперсная система называется аэрозолем. В помещении всегда присутствуют микрочастицы пыли (аэрозоль). К золям с твердой дисперсионной средой относятся рубиновые стекла. В рубиновом стекле микрочастицы золота в ничтожных количествах (0.01 мас. %) распределены по всему объему предварительно расплавленного стекла. Системы средней и грубой дисперсности отличаются от высокодисперсных систем более крупными частицами дисперсной фазы К ним относятся эмульсии (Ж/Ж), суспензии и пасты (Т/Ж), пены (Г/Ж), сыпучие порошки (Т/Г) и твердые пены (Г/Т). Эмульсии (Ж/Ж) – это грубодисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой. Наибольшее практическое применение имеют системы, в которых одной из фаз является вода (В), а другой – нерастворимая или плохо растворимая в воде органическая жидкость, которую условно называют маслом (М). Прямые эмульсии – это капли масла в воде (М/В), например молоко, а обратные эмульсии – капли воды в масле (В/М), например сливочное масло Среди искусственных эмульсий назовем маргарин, лекарственные и косметические мази и кремы. Суспензии (Т/Ж) – грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К таким системам относятся масляные краски эмали, цветные лаки. Обычно они готовятся на растительных или синтетических маслах (дисперсионная среда), дисперсной фазой является твердый краситель. Пасты (Т/Ж) – концентрированные суспензии, например зубная паста содержит воду, твердые частички мела (СаСО3), и другие добавки, включая поверхностно-активные вещества (ПАВ). Пена – грубодисперсная система с газовой дисперсной фазой и жидкой (Г/Ж) или твердой (Г/Т) дисперсионной средой (рис. 14). Мыльная пена – это дисперсная система, где воздух является дисперсной фазой, а вода – дисперсионной средой. Пены с жидкой дисперсионной средой, как правило, неустойчивы, а с твердой дисперсионной средой могут существовать длительное время. Раздробленность приводит к резкому увеличению поверхности раздела между дисперсной фазой и дисперсионной средой. Для оценки межфазовой границы используют понятие удельной поверхности S уд – поверхности раздела фаз S, отнесенной к единице массы дисперсной фазы или ее объему: или мицелла (англ. micelle) — отдельная частица высокодисперсной коллоидной системы с жидкой дисперсионной средой, состоящая из ядра и поверхностной стабилизирующей оболочки. Средний размер мицелл составляет от 1 до 100 нм. К мицеллам относят частицы в лиофильных коллоидах (растворах поверхностноактивных веществ). В лиофильных золях мицелла представляет собой ассоциат молекул (агрегаты, состоящие из десятка и сотен амфильных молекул). В каждой молекуле длинный гидрофобный радикал связан с полярной (гидрофильной) группой. При образовании мицеллы несколько десятков или сотен молекул объединяются так, что гидрофобные радикалы образуют ядро (внутреннюю область), а гидрофильные группы — поверхностный слой мицеллы. Концентрацию поверхностно-активных веществ в растворе, при которой в системе образуются устойчивые мицеллы, находящиеся в равновесии с неассоциированными молекулами поверхностно-активного вещества, называют критической концентрацией мицеллоообразования. Если дисперсионной средой является органическая жидкость, ориентация молекул в мицелле может быть обратной: ядро содержит полярные группы, а гидрофобные радикалы обращены во внешнюю фазу (обратная мицелла).В лиофобных гидрозолях, стабилизованных электролитами, ядро мицеллы окружено двумя слоями противоположно заряженных ионов, т. е. двойным электрическим слоем. Диффузный слой ионов препятствует сближению и агрегированию (сцеплению) частиц. Газообразное состояние вещества. Газовые законы. Химический состав атмосферного воздуха. Газ — агрегатное состояние вещества, в котором его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Газообразное состояние вещества является самым распространенным состоянием вещества Вселенной. Солнце, звезды, облака межзвездного вещества, туманности, атмосферы планет состоят из газов, или нейтральных, или ионизованных (плазмы). Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку. Плотность газов при нормальном давлении на несколько порядков меньше плотности жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно зависит от давления и температуры. Свойства большинства газов — прозрачность, бесцветность и легкость — затрудняло их изучение, поэтому физика и химия газов развивались медленно. Только в 17 в. было доказано, что воздух обладает весом (Э. Торричелли и Б. Паскаль). Наиболее полно изучены были свойства достаточно разряженных газов, в которых расстояния между молекулами при нормальных условиях порядка 10 нм, что значительно больше радиуса действия сил межмолекулярного взаимодействия. Такой газ, молекулы которого рассматриваются как невзаимодействующие материальные точки, называется идеальным газом. Идеальные газы строго подчиняются законам Бойля — Мариотта и Гей-Люссака. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах. Уравнение состояния идеального газа было получено Б. Клапейроном и обобщено Д. И. Менделеевым для любой массы газа. где R универсальная газовая постоянная = 8,31 Дж/моль*К Электрические свойства газов определяются возможностью ионизации молекул или атомов, т. е. появлением в газе электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность газов увеличивается. При температурах выше нескольких тысяч К газ частично ионизуется и превращается в плазму. По магнитным свойствам газы делятся на диамагнитные (инертные газы, СО2, Н2О) и парамагнитные (О2). Молекулы диамагнитных газов не имеют постоянного магнитного момента и приобретают его лишь под действием магнитного поля. Те газы, молекулы которых обладают постоянным магнитным моментом, ведут себя как парамагнетики. Газоые законы - это количественные зависимостти между двумя параметрами газа при фиксированном значении третьего параметра. P, V, T Изопроцессы - это процессы протекающие при неизменном значении одного из параметров.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 3365; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.170.253 (0.028 с.) |

 -Связь – химическая связь, образованная в результате перекрывания электронных орбиталей вдоль линии, соединяющей ядра атомов.
-Связь – химическая связь, образованная в результате перекрывания электронных орбиталей вдоль линии, соединяющей ядра атомов. -Связь – химическая связь, образованная в результате перекрывания электронных орбиталей по обе стороны от линии, соединяющей ядра атомов.
-Связь – химическая связь, образованная в результате перекрывания электронных орбиталей по обе стороны от линии, соединяющей ядра атомов.