
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатные состояния и превращения веществаСодержание книги
Поиск на нашем сайте ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «КАЗАНСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. А.Н. ТУПОЛЕВА-КАИ»
Набережночелнинский филиал
Кафедра КТМП
МАТЕРИАЛОВЕДЕНИЕ
Конспект лекций
Автор: к.ф.-м.н., доцент кафедры КТМП Акст Е.Р.
Набережные Челны, 2013 г.
Материаловедение – это наука о различных материалах, широко используемых в настоящее время для производства разнообразных деталей, механизмов, приборов и конструкций, а также для иных целей. Успех эксплуатации вышеназванных изделий во многом зависит от качеств (свойств) используемых в них материалов. Кроме того, свойства материалов во многом определяют и саму возможность получения из их различных изделий. Материаловедение своей основной задачей считает установление взаимосвязи между свойствами изучаемых материалов их химическим составом и структурой. Получаемые материаловедением знания составляют основу для научного прогнозирования и управления свойствами материалов. Они помогают совершенствовать уже известные материалы и разрабатывать принципиально новые, уникальные материалы. За счёт применения этих, более совершенных материалов могут быть повышены точность, надёжность и долговечность выпускаемых приборов, механизмов и конструкций, а также созданы принципиально новые изделия и устройства, отвечающие современным высоким требованиям. Среди всех материалов, используемых в настоящее время, лидирующее положение по объёму производства и потребления занимают металлы и сплавы. Поэтому важнейшей составной частью материаловедения является металловедение – наука о металлах и сплавах.
1. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
Агрегатные состояния и превращения вещества Как известно, любое вещество может находиться в твёрдом, жидком и газообразном состоянии. Это зависит от температуры, давления, а также от того, как сильно взаимодействуют частицы вещества. Выражаясь точнее, реализация того или иного агрегатного состояния вещества определяется соотношением средней энергии движения его атомов или молекул (Екин) и средней энергии их взаимодействия (Епот). Если Екин >> Епот, вещество находиться в газообразном состоянии. При этом частицы вещества располагаются на относительно больших расстояниях друг от друга и практически не взаимодействуют, за исключением случайных столкновений, в которых они разлетаются подобно биллиардным шарам. Двигаясь почти свободно, частицы газа занимают весь предоставленный им объём, и этим объясняется самое общее свойство всех газов – их летучесть. С понижением температуры уменьшается энергия движения частиц вещества, и всё заметнее начинают проявляться силы межатомного или межмолекулярного взаимодействия. Частицы при случайном столкновении уже не отскакивают друг от друга подобно биллиардным шарам, а как бы «прилипают» друг к другу. Это приводит к переходу вещества в более плотное, конденсированное состояние – сначала в жидкое, а затем и в твёрдое. В жидком состоянии энергия движения частиц вещества сравнима с энергией их взаимодействия (Екин @ Епот). В результате связи между частицами оказываются неустойчивыми, легко нарушаемыми тепловым движением. Частицы часто меняют своих ближайших соседей, совершая так называемые перескоки с места на место, чем и объясняется текучесть жидкостей. В твёрдом состоянии средняя энергия движения частиц вещества не превышает энергию межатомных или межмолекулярных связей (Екин < Епот). Перескоки частиц совершаются крайне редко, и вещество длительное время сохраняет свою форму, т.е. остаётся твёрдым. С изменением температуры или давления изменяется соотношение между энергией движения частиц вещества и энергией их взаимодействия. Повышение температуры приводит к возрастанию Екин , а повышение давления – к возрастанию Епот , и наоборот. Следствием изменения соотношения энергий является переход вещества из одного агрегатного состояния в другое. Как показывает опыт, чаще на практике находят применение материалы, находящиеся в твёрдом состоянии. Аморфное и кристаллическое состояние твёрдых тел Вещества, находящиеся в твёрдом состоянии, могут быть либо аморфными, либо кристаллическими. Аморфное состояние твёрдых тел характеризуется тем, что атомы, молекулы или ионы вещества располагаются в пространстве хаотически. Аналогичную внутреннюю структуру имеют жидкости, но в них частицы вещества за счёт энергии теплового движения совершают частые перескоки с места на место, что и является причиной текучести жидкостей. В аморфных материалах более сильное взаимодействие удерживает частицы вещества вместе и не позволяет им совершать частые перескоки с места на место. В результате образец остаётся твёрдым и не течёт, хотя и имеет структуру жидкости. Учитывая вышесказанное, аморфное состояние обычно отождествляют с переохлаждённой жидкостью, у которой бесконечно высокая вязкость. С повышением температуры вязкость этой «твёрдой жидкости» плавно понижается, вещество размягчается и постепенно переходит из твёрдого состояния в жидкое. Примером материала, находящегося в аморфном состоянии, является обычное оконное стекло, а также янтарь – окаменевшая смола древних деревьев. Кристаллические материалы переходят в жидкое состояние при постоянной температуре, называемой температурой плавления. Обратный переход осуществляется также при постоянной температуре, называемой температурой кристаллизации. В кристаллических твёрдых телах частицы вещества располагаются в пространстве упорядоченно, т.е. выстроены правильными рядами, плоскостями, симметричными блоками, что придаёт отдельным кристаллам (монокристаллам) характерную правильную огранку. Кристаллическое состояние твёрдых тел встречается в природе чаще, чем аморфное, поскольку обладает меньшей свободной энергией и, в силу этого, является более стабильным. С течением времени многие аморфные тела стремятся перейти в кристаллическое состояние. Примерами кристаллических материалов являются различные горные минералы (кварц, гранит, рубин, алмаз и т.д.), а также соль, речной песок и глина, состоящая в основном из мелких кристаллов Al2O3. Металлы и сплавы также являются кристаллическими материалами. Однако они, в отличие от монокристаллов, имеют поликристаллическое строение, т.е. состоят из множества микроскопических кристалликов неправильной формы (зёрен), случайным образом ориентированных в пространстве. Необходимо отметить, что одно и то же вещество может быть получено как в кристаллическом, так и в аморфном состоянии. Например, в металлах и сплавах при их сверхбыстром охлаждении из жидкого или газообразного состояний не успевает сформироваться упорядоченная кристаллическая структура и образуется аморфное твёрдое тело (metal glass - металлическое стекло). При этом свойства аморфного металла могут заметно отличаться от свойств кристаллического образца, что свидетельствует о важности внутренней атомной структуры материала в формировании его свойств. Аморфное состояние металлов чаще всего оказывается крайне нестабильным при комнатной температуре. С течением времени наблюдается переход из такого состояния в более стабильное кристаллическое состояние и этот процесс ускоряется с повышением температуры. В тоже время путём подбора химического состава металлических материалов их аморфное состояние иногда удаётся застабилизировать. Примером может служить металлическое стекло Fe80B20, аморфное состояние которого является достаточно стабильным при комнатной и более высоких температурах.
Структура кристаллов Следует различать понятия кристаллическая решётка и структура кристалла. Структура кристалла – это физическая реальность, конкретное расположение в пространстве различных атомов. Кристаллическая решётка – это геометрический образ структуры, отражающий лишь симметрию расположения частиц кристалла. Для более полного описания структуры кристаллов используют понятие базис. Базисом кристаллической структуры называют совокупность определённым образом расположенных в пространстве различных атомов, приходящихся на одну элементарную ячейку. Т.е. перечисляются все полностью принадлежащие одной элементарной ячейке атомы, вместе с их координатами в этой ячейке. Таким образом, если элементарная ячейка определяет размер и форму «элементарных кирпичиков», из которых построен кристалл, то базис определяет «материал» этих кирпичиков. Другими словами, базис это тот «элементарный блок вещества», периодическим повторением которого в пространстве воспроизводится весь рассматриваемый кристалл. Базис сложных органических кристаллов, состоящих из больших молекул, может включать в себя несколько тысяч различных атомов. В простейшем случае, когда в узлах кристаллической решётки расположены однотипные атомы или ионы, базис состоит только из одной или нескольких таких частиц. Подобная ситуация характерна, в частности, для металлов. Если структуру металла описывает кристаллическая решётка с примитивной ячейкой (рис. 1), то базис такой структуры состоит только из одного атома данного металла. (Действительно, в данном случае, каждый атом металла, расположенный в узле кристаллической решётки, находится на пересечении 8 аналогичных ячеек и принадлежит рассматриваемой ячейке только на ⅛ часть. Но поскольку таких узлов в ячейке 8, то полностью принадлежит ей ровно один атом, составляющий по определению базис. Перемещая этот атом–базис вдоль координатных осей с шагом, соответствующим периодам кристаллической решётки, воспроизводится вся пространственная структура металла). В случае объёмоцентрированной ячейки базис составляют 2 атома металла (атом в центре ячейки полностью принадлежит данной ячейке, плюс один атом дают узлы, расположенные в вершинах ячейки), а гранецентрированной – 4 (каждый из 6 атомов, расположенных в центрах граней, принадлежит рассматриваемой ячейке только на ½ часть). Система симметрии, величина периодов решётки и базис полностью определяют кристаллическую структуру конкретного материала. Если известны эти параметры, то известной считается и структура кристалла. Однако для более полного описания структуры иногда используют такие дополнительные параметры как координационное число и коэффициент компактности. Координационным числом называют число ближайших равноудалённых соседей любого атома. Если в качестве примера рассматривать структуру, изображенную на рис. 1, то для неё координационное число равно шести. Коэффициент компактности (степень компактности) представляет собой отношение объёма, занятого атомами, ко всему объёму элементарной ячейки. В случае чистых металлов коэффициент компактности может достигать величины 0,74. Это означает, что 74 % объёма металла занято атомами, а остальную его часть составляют пустоты (поры).
Анизотропия кристаллов Анизотропия – это зависимость свойств материала от направления.Материал считается изотропным, когда его свойства во всех направлениях одинаковые. Если же с изменением направления свойства материала изменяются, материал считается анизотропным. Анизотропия характерна для кристаллов и обусловлена их упорядоченной структурой. В кристаллах в различных направлениях атомы располагаются с различной плотностью, т.е. на различном расстоянии друг от друга, что отражается на силе взаимодействия атомов. Как следствие, свойства кристаллов в различных направлениях оказываются различными. Например, в кубическом кристалле в направлении координатных осей атомы вещества располагаются на расстоянии друг от друга равном а (рис.1). В направлении диагонали атомы располагаются на расстоянии а Анизотропия распространяется практически на все свойства кристаллов. Так, кристалл в одном направлении лучше, чем в другом может проводить тепло, электрический ток, свет, лучше намагничиваться и т.д. При этом, чем ниже система симметрии кристалла, тем сильнее проявляется анизотропия его свойств. В аморфных материалах, из-за хаотического внутреннего строения, атомы в различных направлениях располагаются примерно с одинаковой плотностью. В результате свойства данных материалов в различных направлениях оказываются одинаковыми, т.е. вещество оказывается изотропным. Металлы и сплавы, полученные в обычных условиях, также очень часто обнаруживают равенство свойств в различных направлениях, хотя и являются материалами кристаллическими, а не аморфными. Это объясняется их зернистым строением. Зёрна данных материалов, будучи кристаллами, в различных направлениях обнаруживают различные свойства, однако в целом материал оказывается изотропным, поскольку зёрна случайным образом ориентированы в пространстве и при сложении свойств в каждом направлении получается примерно одна, усреднённая величина. Такую изотропию называют ложной изотропией или квазиизотропией. Иногда зёрна поликристаллических материалов оказываются ориентированными преимущественно в одном направлении. Например, зёрна металлов и сплавов при пластическом деформировании вытягиваются в направлении деформации. Такое явление называют текстурой. При появлении текстуры свойства кристаллических материалов вновь начинают зависеть от направления, т.е. материал оказывается анизотропным.
Полиморфизм металлов Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры материала. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения. Различные кристаллографические модификации одного материала принято обозначать буквами греческого алфавита α, β, g, δ, ε, σ и т.д. Модификацию, наблюдаемую при самых низких температурах, обозначают буквой α, при более высоких температурах – β, и т.д. Ярким примером полиморфизма у неметаллических материалов является наличие двух кристаллографических модификаций чистого углерода, известных как алмаз и графит. Оба материала являются идентичными по химическому составу и отличаются лишь кристаллической структурой. В результате свойства алмаза и графита оказываются существенно различными. Графит это мягкий, хрупкий и непрозрачный материал, в то время как алмаз является одним из наиболее твёрдых минералов, встречающихся в природе, и, как правило, прозрачен. Полиморфизм достаточно распространённое явление в мире металлов. Многие из металлов обладают полиморфизмом. Например, у Со с повышением температуры ГПУ-структура перестраивается в ГЦК-структуру, а у Ti ГПУ-структура перестраивается в ОЦК-структуру. Наиболее ярко полиморфизм проявляется у железа, которое при нагреве два раза меняет свою кристаллическую структуру (рис. 11).
ОЦК ГЦК ОЦК жидкость
α-Fe β-Fe γ-Fe δ-Fe 768 911 1392 1539 Т, °С.
Рис. 11. Кристаллографические модификации железа. При температурах ниже 768°С железо является ферромагнитным материалом, а при температурах выше 768°С – парамагнитным. Ранее считали, что изменение магнитных свойств железа связано с изменением его кристаллической структуры и поэтому ферромагнитное железо стали обозначать α-Fe, а парамагнитное – β-Fe. Позже выяснилось, что это не так. И то и другое железо имеют одинаковую ОЦК-структуру. Однако исторически сложившееся подразделение железа на α-Fe и β-Fe сохранили. В настоящее время железо с ОЦК-структурой, наблюдаемое в интервале температур до 911 ° С, называют α-железом. В интервале температур от 911 до 1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК-структуры более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение размера (объёма) образца. В интервале температур от 1392 до 1539°С железо вновь имеет ОЦК-структуру. Однако период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe. При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав. Другим ярким примером полиморфизма металлов является полиморфизм олова. При температурах ниже -30°С белое и пластичное β-олово (β –Sn) превращается в свою α-модификацию, т.е. в α-Sn, которое является серым порошком. Не имея никакого представления о природе данного явления, его, в своё время, назвали «оловянной чумой». Явление полиморфизма в очередной раз подчёркивает, что свойства материалов определяются не только их химическим составом, но и в значительной степени их структурой. 3. ФОРМИРОВАНИЕ МИКРОСТРУКТУРЫ МЕТАЛЛОВ И СПЛАВОВ ПРИ ЗАТВЕРДЕВАНИИ
Процесс перехода вещества из жидкого состояния в твёрдое кристаллическое состояниеназывают кристаллизацией. Обратный процесс называют плавлением. Рассмотрим подробно процесс кристаллизации металлов.
Кривые охлаждения металлов С увеличением степени переохлаждения расплава возрастает выигрыш в энергии (Δ F), связанный с переходом вещества из жидкого состояния в кристаллическое (на рис. 3.1. ΔF2 > ΔF1 ). Эту выделяющуюся при кристаллизации энергию называют скрытой теплотой кристаллизации. Скрытая теплота кристаллизации компенсирует отвод тепла от охлаждаемого жидкого металла пока идёт процесс его затвердевания. В результате температура металла при кристаллизации остается постоянной. Этот факт отражает теоретическая кривая охлаждения чистого металла, содержащая при температуре TS горизонтальную площадку (рис. 3.2.).
Реальная кривая охлаждения металла выглядит несколько иначе. Она отражает факт переохлаждения расплава и поэтому здесь горизонтальная площадка располагается при температурах ниже TS. Кроме того, на площадке наблюдается выброс вверх, обусловленный бурным выделением скрытой теплоты кристаллизации в начальный момент затвердевания расплава. Выброс тем больше, чем большая масса металла кристаллизуется.
Строение слитка металла Зависимость размера зёрен металла от степени переохлаждения расплава наглядно демонстрирует структура слитка металла, в частности структура слитка затвердевшей углеродистой стали (рис. 3.4.). Этот слиток обнаруживает три характерные зоны: мелкозернистую корочку – 1, зону вытянутых столбчатых кристаллов – 2 и зону неориентированных крупных кристаллов – 3. Кристаллизация расплава начинается с формирования зоны 1, т.е. со стенок литейной формы, где горячий расплав соприкасается с относительно холодной поверхностью формы. Поскольку степень переохлаждения расплава здесь очень высокая, зёрна металла оказываются мелкими.
Рис. 3.4. Структура слитка стали
На следующем этапе кристаллизации формируется зона столбчатых кристаллов (зона 2). Степень переохлаждения расплава здесь значительно меньше и поэтому зёрна вырастают крупными. В тоже время рост кристаллов происходит в сторону противоположную отводу тепла – от стенок к центру слитка, поэтому зёрна оказываются ориентированными перпендикулярно стенкам формы. Центральная часть слитка (зона 3) формируется на заключительном этапе кристаллизации. Поскольку степень переохлаждения расплава здесь небольшая, а тепло отводится во все стороны равномерно, зёрна в этой зоне оказываются крупными и неориентированными, т.е. округлыми. В верхней части слитка формируется усадочная раковина, что связано с уменьшением объема металла при затвердевании. В этой области обычно собираются всевозможные загрязнения и неметаллические включения. Поэтому область слитка с усадочной раковиной подлежит удалению.
4. ДЕФОРМАЦИЯ И МЕХАНИЧЕСКИЕ СВОЙСТВА МАТЕРИАЛОВ
Разрушение материалов Разрушение это заключительная стадия деформирования материала. Оно представляет собой разделение материала на отдельные составные части. С точки зрения атомной структуры, разрушение выглядит как разрыв межатомных связей. Разрыв может происходить двумя способами: 1) Под воздействием напряжений перпендикулярных плоскости разрыва (разрыв сколом или отрывом). 2) Под воздействием напряжений параллельных плоскости разрыва (то есть разрыв сдвигом или скольжением). В реальных материалах обычно имеют место оба вида разрыва. Различают разрушение хрупкое и вязкое. При вязком разрушении наблюдается значительная пластическая деформация материала перед разрушением, при этом разрыв межатомных связей происходит преимущественно сдвигом или скольжением. При хрупком разрушении пластическая деформация значительно меньше или совсем отсутствует, а разрыв межатомных связей происходит преимущественно сколом или отрывом. Чисто вязкое разрушение наблюдают у таких материалов как глина, пластилин, а чисто хрупкое - у и т.д. Большинству реальных материалов присущи одновременно оба вида разрушения, а подразделение материалов на хрупкие или вязкие осуществляется по преобладающему механизму разрушения. Так, глина и пластилин являются вязкими материалами, а стекло и алмаз – хрупкими. Вид разрушения характеризуется величиной работы разрушения, видом трещины и поверхности излома, а также скоростью распространения трещины. При вязком разрушении работа разрушения значительно больше, чем при хрупком разрушении. Работа разрушения пропорциональна площади под кривой растяжения материала:
Хрупкое разрушение наиболее опасно. Обычно оно начинается с некоторого дефекта: царапины на поверхности, выбоины, поры, неметаллических включений, сварного шва, технологических отверстий и изгибов и т.д. Хрупкое разрушение происходит в три стадии: 1) Зарождение микротрещины на дефектах. 2) Подрастание трещины до критического размера. 3) Распространение трещины через весь образец, т.е. возникновение магистральной трещины. При хрупком разрушении третья стадия происходит самопроизвольно без дополнительного деформирования образца, то есть без дополнительного подвода энергии извне. Трещина растёт за счёт упругой энергии, накопленной на предыдущей стадии деформирования. Скорость распространения такой трещины сравнима со скоростью распространения звука в данном материале. При вязком разрушении скорость распространения трещины зависит от скорости деформирования материала. При этом требуется подвод энергии извне, т.е. дополнительная деформация. Хрупкая трещина имеет малый угол раскрытия, т.е. является острой трещиной и, как правило, ветвится. Вязкая трещина имеет большой угол раскрытия, т.е. является тупой трещиной.
Поверхность излома при хрупком разрушении оказывается блестящей и под микроскопом обнаруживает платообразную структуру:
При вязком разрушении поверхность излома оказывается матовой и под микроскопом обнаруживает волокнистую структуру: У многих вязких металлов при понижении температуры наблюдается смена преобладающего механизма разрушения. Свойство материалов разрушатся хрупко при низких температурах называют хладноломкостью. В заключение необходимо отметить, что стадия разрушения материала, с момента появления первых повреждений, может составлять до 90% долговечности конструкции.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «КАЗАНСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. А.Н. ТУПОЛЕВА-КАИ»
Набережночелнинский филиал
Кафедра КТМП
МАТЕРИАЛОВЕДЕНИЕ
Конспект лекций
Автор: к.ф.-м.н., доцент кафедры КТМП Акст Е.Р.
Набережные Челны, 2013 г.
Материаловедение – это наука о различных материалах, широко используемых в настоящее время для производства разнообразных деталей, механизмов, приборов и конструкций, а также для иных целей. Успех эксплуатации вышеназванных изделий во многом зависит от качеств (свойств) используемых в них материалов. Кроме того, свойства материалов во многом определяют и саму возможность получения из их различных изделий. Материаловедение своей основной задачей считает установление взаимосвязи между свойствами изучаемых материалов их химическим составом и структурой. Получаемые материаловедением знания составляют основу для научного прогнозирования и управления свойствами материалов. Они помогают совершенствовать уже известные материалы и разрабатывать принципиально новые, уникальные материалы. За счёт применения этих, более совершенных материалов могут быть повышены точность, надёжность и долговечность выпускаемых приборов, механизмов и конструкций, а также созданы принципиально новые изделия и устройства, отвечающие современным высоким требованиям. Среди всех материалов, используемых в настоящее время, лидирующее положение по объёму производства и потребления занимают металлы и сплавы. Поэтому важнейшей составной частью материаловедения является металловедение – наука о металлах и сплавах.
1. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
Агрегатные состояния и превращения вещества Как известно, любое вещество может находиться в твёрдом, жидком и газообразном состоянии. Это зависит от температуры, давления, а также от того, как сильно взаимодействуют частицы вещества. Выражаясь точнее, реализация того или иного агрегатного состояния вещества определяется соотношением средней энергии движения его атомов или молекул (Екин) и средней энергии их взаимодействия (Епот). Если Екин >> Епот, вещество находиться в газообразном состоянии. При этом частицы вещества располагаются на относительно больших расстояниях друг от друга и практически не взаимодействуют, за исключением случайных столкновений, в которых они разлетаются подобно биллиардным шарам. Двигаясь почти свободно, частицы газа занимают весь предоставленный им объём, и этим объясняется самое общее свойство всех газов – их летучесть. С понижением температуры уменьшается энергия движения частиц вещества, и всё заметнее начинают проявляться силы межатомного или межмолекулярного взаимодействия. Частицы при случайном столкновении уже не отскакивают друг от друга подобно биллиардным шарам, а как бы «прилипают» друг к другу. Это приводит к переходу вещества в более плотное, конденсированное состояние – сначала в жидкое, а затем и в твёрдое. В жидком состоянии энергия движения частиц вещества сравнима с энергией их взаимодействия (Екин @ Епот). В результате связи между частицами оказываются неустойчивыми, легко нарушаемыми тепловым движением. Частицы часто меняют своих ближайших соседей, совершая так называемые перескоки с места на место, чем и объясняется текучесть жидкостей. В твёрдом состоянии средняя энергия движения частиц вещества не превышает энергию межатомных или межмолекулярных связей (Екин < Епот). Перескоки частиц совершаются крайне редко, и вещество длительное время сохраняет свою форму, т.е. остаётся твёрдым. С изменением температуры или давления изменяется соотношение между энергией движения частиц вещества и энергией их взаимодействия. Повышение температуры приводит к возрастанию Екин , а повышение давления – к возрастанию Епот , и наоборот. Следствием изменения соотношения энергий является переход вещества из одного агрегатного состояния в другое. Как показывает опыт, чаще на практике находят применение материалы, находящиеся в твёрдом состоянии.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 466; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.013 с.) |

 , а в направлении пространственной диагонали – а
, а в направлении пространственной диагонали – а 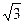 . Очевидно, такой кристалл легче разорвать в направлении пространственной диагонали, чем в направлении координатных осей, где он обнаруживает наибольшую прочность из-за того, что атомы расположены ближе и сильнее взаимодействуют.
. Очевидно, такой кристалл легче разорвать в направлении пространственной диагонали, чем в направлении координатных осей, где он обнаруживает наибольшую прочность из-за того, что атомы расположены ближе и сильнее взаимодействуют.












