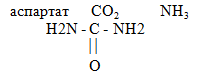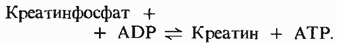Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Плазма и сыворотка крови, их химический состав. Нормальные значения общих свойств крови взрослого человека. Нормальные значения специфических свойств крови взрослого человека.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Плазма и сыворотка крови, их химический состав. Нормальные значения общих свойств крови взрослого человека. Нормальные значения специфических свойств крови взрослого человека. Межклеточное вещество крови называется плазмой крови, она составляет 55% от общего объема крови. Для получения плазмы крови, цельную кровь центрифугируют с антикоагулянтом, например с гепарином. Существует также понятие сыворотка крови, в отличие от плазмы сыворотка крови не содержит белок фибриноген. Сыворотку крови получают при центрифугировании цельной крови без антикоагулянта. Химический состав растворимых в плазме крови веществ относительно постоянен, так как существуют мощные нервные и гуморальные механизмы, поддерживающие гомеостаз. Растворитель, Сухой остаток, Углеводы, Липиды, Белки, Ферменты, Минеральные вещества, Низкомолекулярные органические вещества, Растворенные газы, Гормоны и медиаторы Все жидкости организма обладают рядом общих свойств: объемом, плотностью, вязкостью, рН и осмотическим давлением. Нормальные значения общих свойств крови взрослого человека: 1. Объем в среднем 4,6л или 6—8% от массы тела. У мужчин 5,2л, у женщин 3,9л. 2. Удельная плотность цельной крови —1050—1060 г/л, плазмы —1025—1034 г/л, эритроцитов —1080-1097 г/л. 3. Вязкость крови 4-5 относительных единиц (в 4-5 раз выше вязкости воды). У мужчин – 4,3-5,3 мПа*с, у женщин 3,9-4,9 мПа*с. 4. рН капиллярной крови = 7,37-7,45, рН венозной крови = 7,32-7,42. 5. Осмотическое давление = 7,6 атм. (определяется осмотической концентрацией – суммой все частиц находящихся в единице объема. Т=37С.). В основном зависит от NaCl и других низкомолекулярных веществ При этом у некоторых жидкостей организма могут быть подчеркнуты специфические свойства, такие как цвет, прозрачность, запах и т.д. К специфическим свойствам крови относятся онкотическое давление, СОЭ, цветовой показатель и гематокрит. Нормальные значения специфических свойств крови взрослого человека: 1. Онкотическое давление =0,03 атм. 2. СОЭ: мужчины – 1-10 мм/ч, женщины – 2-15 мм/ч. 3. Цветовой показатель – 0,86-1.05 4. Гематокрит – 40—45% (у мужчин 40-48%, у женщин 36-42%). Отношение форменных элементов крови, в процентах, к общему объему крови.
Альбумины, их характеристики и функции. Основные фракции глобулинов, их функции. I. Альбумины Основным белком этой фракции является альбумин. Альбумин. Простой белок из 585 АК с массой 66кДа, имеет 17 дисульфидных мостиков, много дикарбоновых АК, обладает высокой гидрофобностью. У альбумина наблюдается полиморфизм. Синтезируется в печени (12 г/сут), утилизируется почками, энтероцитами и др. тканями. Т½=20 дней. 60% альбуминов находиться в межклеточном веществе, 40% - в кровяном русле. В плазме альбуминов 40-50г/л, они составляют 60% всех белков плазмы крови. Функции: поддержание онкотического давления (вклад 80%), транспорт свободных жирных кислот, билирубина, жёлчных кислот, стероидных и тиреоидных гормонов (20% Т4, 11% Т3), ХС, лекарств, неорганических ионов (Cu2+, Ca2+, Zn2+), является источником аминокислот. Транстиретин (преальбумин). Тетрамер. Молекулярная масса 54 кДа. В плазме 0,25г/л. Белок острой фазы (5 группа). Транспортирует в небольших количествах тироксин (11%), трийодтиронин (9%) и ретинол. Снижается при голодании. Сосудистые, плазменные и тромбоцитарные факторы свёртывания крови. Скрининговые методы исследования коагуляционного гемостаза. Существует набор рекомендуемых скрининговых тестов для диагностики состояния системы гемостаза: АЧТВ (активированное частичное тромбопластиновое время) Протромбиновое время (по Квику) Тромбиновое время Фибриноген Протромбиновое время (ПВ) Протромбиновое время – широко используемый скрининговый тест для оценки состояния внешнего и общего путей когуляционного каскада свертывания плазмы. Нормальные величины ПВ для взрослых составляют 11-15 сек, для новорожденных – 13-18 сек. Увеличение ПВ говорит о наклонности к гипокоагуляции. Укорочение ПВ говорит о наклонности к гиперкоагуляции и может быть отмечено в начальных стадиях тромбоза глубоких вен нижних конечностей, при полицитемии, в последние месяцы беременности. Тромбиновое время (ТВ) Тромбиновое время (ТВ) является третьим по значимости базисным скрининговым тестом. Тест характеризует конечный этап процесса свертывания – превращение фибриногена в фибрин под действием тромбина, на него влияет концентрация фибриногена в плазме и наличие продуктов деградации фибрина (ПДФ). Количественное определение фибриногена по методу Клаусса является базисным тестом исследования гемостаза. Образование фибрина и его стабилизация представляют собой финальный этап формирования тромба, при котором растворимый фибриноген превращается в нерастворимый фибрин под действием тромбина и фактора XIII. При атеросклерозе наблюдается устойчивое увеличение уровня фибриногена, трудно корригируемое лекарственными препаратами. В результате риск сердечно-сосудистых заболеваний повышается с возрастанием исходного содержания фибриногена в интервале 3,0-4,5 г/л. Обнаружено, что повышение уровня фибриногена в плазме крови больных сердечно-сосудистыми заболеваниями предшествует развитию инфаркта миокарда и инсульта. Корреляция между уровнем фибриногена и развитием этих осложнений особенно четко прослеживается у пациентов молодого и среднего возраста. Определение уровня фибриногена – наиболее чувствительный тест для выявления бессимптомных стадий заболевания периферических артериальных сосудов 27. Состав ренин-ангиотензин- альдостероновой системы (РААС), ее биологическая роль. Важнейшим фактором эндотелиальной дисфункции является хроническая гиперактивация ренин-ангиотензин-альдостероновой системы. Основной целью активации РАС является поддержание системного АД и достаточного кровотока в таких жизненно важных органах, как головной мозг, сердце, почки и печень. РААС играет роль "скорой помощи" при кровотечении, падении артериального давления, инфаркте миокарда и других острых ситуациях. Она также оказывает регулирующее влияние на сердечно- сосудистый и почечный гомеостаз, способствует развитию компенсаторных процессов. Однако при длительной активации РААС наблюдается спазм и повышение общего периферического сопротивления сосудов, гипоперфузия органов и тканей, задержка жидкости, увеличение объема циркулирующей крови, повышение чувствительности миокарда к токсическому влиянию катехоламинов, ремоделирование миокарда и сосудов, уменьшение отношения просвета сосуда к толщине его стенки, развитие миокардиального и периваскулярного фиброза. РААС проявляет свои эффекты через гормон ангиотензин II (АТII), прогормон (предшественник) которого - ангиотензиноген - вырабатывается в клетках печени. Ангиотензиноген расщепляется почечным ренином с образованием неактивного декапептида (пептида, состоящего из 10 аминокислотных остатков) ангиотензина I. Последний в результате ферментативного воздействия ангиотензин-превращающего фермента (АПФ, или кининаза II) теряет 2 аминокислоты (гистидин и лейцин) и превращается в активный октапептид AТII, являющийся одним из самых сильных вазоконстрикторных агентов. Циркулируя в системе кровообращения, AТII оказывает свое действие в различных органах и тканях: в ЦНС, почках, надпочечниках, сердце, сосудах в основном через два типа рецепторов - АТ1 и АТ2. В дальнейшем AТII метаболизируется (утилизируется) в AТIII и ряд других малоактивных пептидов. 90% всего объема РАС приходится на органы и ткани (10% - на плазму), среди которых сосудистый эндотелий занимает первое место, поэтому гиперактивация РААС играет большую роль в развитии эндотелиальной дисфункции. 28. Ренин: место образования, структура, функции. Ренин - ангиотензиногеназа — компонент ренин-ангиотензиновой системы, регулирующей кровяное давление. Ренин — протеолитический фермент позвоночных животных и человека. Первичная структура предшественника ренина включает 406 аминокислот. После отщепления двух фрагментов (пре- и пропептида) белок превращается в собственно ренин, состоящий из 340 аминокислот. Ренин вырабатывается юкстагломерулярными клетками в стенках артериол почечных клубочков, откуда поступает в кровь и лимфу. Хотя по месту синтеза его можно отнести к гормонам, ренин не является истинным гормоном, так как не имеет клеточной мишени, а воздействует на другой белок крови. Секреция ренина в значительной мере контролируется традиционным эндокринным механизмом обратной связи. Ренин действует на другой гликопротеин крови ангиотензиноген, специфически гидролизуя пептидную связь между двумя остатками лейцина. При этом образуется неактивный декапептид (ангиотензин I), который превращается ферментативно (под действием ангиотензин-конвертирующего фермента) в активный гормон ангиотензин II (гипертензин, или ангиотонин), который сужает кровеносные сосуды и стимулирует секрецию альдостерона надпочечниками. Эти два эффекта приводят к росту артериального давления. Ферменты, подобные ренину, найдены в матке, плаценте, слюнных железах, в мозге и в стенках некоторых крупных артерий. 29.Ангиотензин II (Анг II): структура, пути образования, функции. Ангиотензины — пептиды, образующиеся в организме из ангиотензиногена, представляющего собой гликопротеид (альфа2-глобулин) плазмы крови, синтезирующийся в печени. Под воздействием ренина (фермент, образующийся в юкстагломерулярном аппарате почек) полипептид ангиотензиноген, не обладающий прессорной активностью, гидролизуется, образуя ангиотензин I — биологически неактивный декапептид, легко подвергающийся дальнейшим преобразованиям. Под действием ангиотензинпревращающего фермента, образующегося в легких, ангиотензин I превращается в октапептид — ангиотензин II, являющийся высокоактивным эндогенным прессорным соединением. Под воздействием ренина (фермент, образующийся в юкстагломерулярном аппарате почек) полипептид ангиотензиноген, не обладающий прессорной активностью, гидролизуется, образуя ангиотензин I — биологически неактивный декапептид, легко подвергающийся дальнейшим преобразованиям. Под действием ангиотензинпревращающего фермента, образующегося в легких, ангиотензин I превращается в октапептид — ангиотензин II, являющийся высокоактивным эндогенным прессорным соединением. Ангиотензин II быстро метаболизируется (период полураспада — 12 мин) при участии аминопептидазы А с образованием ангиотензина III и далее под влиянием аминопептидазы N — ангиотензина IV, обладающих биологической активностью/
Синтез мочевины. Аммиак тем или иным путем поступивший в печень или образовавшийся в гепатоцитах вступает в цикл мочевинообразования открытый в 1932 г. Синтез мочевины начинается с образования в митохондриях печени карбомоилфосфата. Вторая реакция мочевинообразования протекает так же в митохондриях (трансфераза обеспечивает перенос остатка карбомонила на молекулу арнитина-монокарбоновая кислота содержащая 5 углеродных атомов). Образуется аминокислота - цитрулин. Дальнейшие реакции мочевинообразования протекают в цитозоле. В следующей реакции участвует цитрулин и аспартат (фермент - аргининосукцинатсинтетаза). В этой реакции участвуют цитрулин и аспартат. Реакция эгнергозависимая. В ходе реакции происходит расщепление АТФ до АМФ и пирофосфата и образуется аргининоянтарная кислота или аргининосукцинат. Аспартат образуется в ходе реакций трансаминирования из оксалоацетата - промежуточного продукта цикла Кребса, который подвергается реакции взаимодействия с глутоматом и образуется аспартат. Дальше в ходе следующего процесса происходит лиазная реакция (лиазное расщепление - расщепление не гидролитическим путем) (фермент- аргининосукцинатлиаза). Происходит расщепление и в итоге образуется аминокислота аргинин и отщепляется остаток в виде фумаровой кислоты. Фумаровая кислота - промежуточный продукт цикла Кребса, присоединяя воду превращается в малат, малат дегидрируется и превращается в оксалоацетат, а оксалоацетат за счет трансаминирования может превращаться в аспартат, который поставляет один атом азота. Последняя реакция мочевинообразования катализируемая ферментом обладающим абсолютной специфичностью аргиниза. Происходит расщепление аргинина, образуется полный амид угольной кислоты получивший название мочевина и регенирирует орнитин. Отсюда название цикла - орнитиновый цикл мочевинообразования. В ходе следующей реакции арнитин вновь вступая в реакцию взаимодействия с карбомоилфосфататом может давать цитрулин и дальнейшее повторение реакций приводит к увеличению синтезированной мочевины. Необратимой реакцией в этом процессе является реакция с участием аргининосукцинатсинтетазы - термодинамический контроль направления процесса в целом. Суммарное уравнение мочевинообразования. СО2 + NH3 + аспартат + 3АТФ + 2Н2О → мочевина + фумарат + 2AДФ + АМФ + 4Н3РО4
Для определения мочевины используют кровь (сыворотку или плазму) и суточную мочу. Важное внимание должно уделяться правильному сбору и хранению образцов для исследования. Кровь для исследования берут утром натощак. При заборе крови для определения мочевины в ряде случаев нельзя использовать фторидные или аммиачные антикоагулянты, а также цитрат натрия (при использовании уреазных методов). Концентрация мочевины в сыворотке или плазме крови устойчива в течение 1 недели при хранении при 4 °C или не менее 6 месяцев при –20°C. Нежелательно использовать гемолизированную, хилезную, липемическую или иктеричную сыворотку. Однако в ряде источников указывается, что на результаты исследований, проводимых в кинетическом варианте с большими разведениями образца, билирубин, гемоглобин или липемия, как правило, не влияют. Мочу для определения мочевины используют суточную, собирая ее соответственно основным правилам сбора суточной мочи. Хранить мочу до анализа следует при температуре 4–8 °C. Использовать для анализа мутные образцы крайне нежелательно. Для устранения мутности образцы желательно отцентрифугировать при 1500-3000 об/мин. При мутности мочи, связанной с бактериальным загрязнением образца или денатурацией белковых компонентов вследствие нарушения условий хранения, от анализа следует отказаться. Следует помнить, что концентрация мочевины в моче высокая, а потому образцы мочи необходимо разводить перед исследованием (обычно используется разведение в 20 — 50 раз), а после определения мочевины результат умножить на коэффициент разведения. При оценке результатов исследования следует учитывать, что в ряде случаев на определение уровня мочевины в материале in vitro могут влиять некоторые лекарственные препараты, применяемые пациентом, что в свою очередь может приводить к ложному занижению или завышению результатов (химическое влияние). Показаниями для выполнения данного лабораторного теста являются: o все формы ишемической болезни сердца; o системные заболевания соединительной ткани; o артериальная гипертензия (независимо от длительности ее существования); o выявление отклонений в общем анализе мочи при скрининговом исследовании; o болезни печени, сопровождающиеся нарушением ее функции (гепатит, цирроз); o подозрение на воспалительные или инфекционные заболевания почек; o заболевания желудочно-кишечного тракта, которые характеризуются снижением абсорбции пищевых ингредиентов (целиакия). 35. Биологическая роль цикла мочевинообразования. Врожденные дефекты фер-ментов орнитинового цикла. Локализация ферментов и основные клинические про-явления. Ферменты по локализации делят на 3 группы: I– общие ферменты (универсальные) II- органоспецифические III- органеллоспецифические Общие ферменты обнаруживаются практически во всех клетках, обеспечивают жизнедеятельность клетки, катализируя реакции биосинтеза белка и нуклеиновых кислот, образование биомембран и основных клеточных органелл, энергообмен. Общие ферменты разных тканей и органов, тем не менее, отличаются по активности. Органоспецифичные ферменты свойственны только определенному органу или ткани. Например: Для печени – аргиназа. Для почек и костной ткани – щелочная фосфатаза. Для предстательной железы – КФ (кислая фосфатаза). Для поджелудочной железы – α-амилаза, липаза. Для миокарда – КФК (креатинфосфокиназа), ЛДГ, АсТ и т.д. Внутри клеток ферменты также распределены неравномерно. Одни ферменты находятся в коллоидно-растворенном состоянии в цитозоле, другие вмонтированы в клеточных органеллах (структурированное состояние). Органеллоспецифические ферменты. Разным органеллам присущ специфический набор ферментов, который определяет их функции. Органеллоспецифические ферменты это маркеры внутриклеточных образований, органелл:
В результате в клетке образуются отсеки (компартменты), которые отличаются набором ферментов и метаболизмом (компартментализация метаболизма). Среди ферментов выделяется немногочисленная группа регуляторных ферментов, которые способны отвечать на специфические регуляторные воздействия изменением активности. Эти ферменты имеются во всех органах и тканях и локализуются в начале или в местах разветвления метаболических путей. Строгая локализация всех ферментов закодирована в генах. Определение в плазме или сыворотке крови активности органо- органеллоспецифических ферментов широко используется в клинической диагностике. Орнитиновый цикл в печени выполняет 2 функции: 1) превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; 2) синтез аргинина и пополнение его фонда в организме. Дефекты ферментов орнитинового цикла характеризуются гипераммониемией в условиях катаболизма или белковой нагрузки.Первичные нарушения орнитинового цикла включают дефицит карбамоил-фосфатсинтетазы (КФС), дефицит орнитин-транскарбамилазы (ОТК), дефицит аргинин-сукцинатсинтетазы (цитруллинемия), дефицит аргининосукцинатлиазы (аргинин-янтарная ацидурия) и дефицит аргиназы (аргининемия). Также есть сообщения о дефиците Nацетилглютаматсинтетазы (НАГС). Чем выше находится дефектный фермент, тем более выражена гипераммониемия; поэтому заболевания в порядке убывания тяжести располагаются следующим образом: дефицит НАГС, дефицит КФС, ОТК, цитруллинемия, аргинин-янтарная ацидурия и аргининемия. Тип наследования всех нарушений орнитинового цикла аутосомно-рецессивный, за исключением дефицита ОТК, который является Х-сцепленным.
36. Роль в организме креатинфосфата. Образование креатинина в организме, ме-тоды определения. Диагностическое значение определения содержания креатинина в крови. "Нормальные величины " кретинина в крови. Среди высокоэнергетических фосфорилированных соединений имеется одно, играющее особую роль в энергетике возбудимых тканей, таких, как мышечная и нервная. Это соединение, креатинфосфат, или фосфокреатин, служит резервуаром высокоэнергетических фосфатных групп. гидролиза креатинфосфата несколько превышает гидролиза АТР. Креатинфосфат может передавать свою фосфатную группу на ADP в реакции, катализируемой креатинкиназой:
Благодаря креатинфосфату концентрация АТР в мышечных клетках поддерживается на постоянном и притом довольно высоком уровне. Особенно это существенно для скелетных мышц, работающих с перерывами, но иногда очень напряженно с большой скоростью. Всякий раз, когда часть АТР мышечной клетки расходуется на сокращение, в результате гидролиза АТР образуется ADP. Креатинфосфат при участии креатинкиназы быстро передает свою фосфатную группу молекулам ADP, и нормальный уровень АТР восстанавливается. Содержание креатинфосфата в мышцах в 3-4 раза превышает содержание АТР; поэтому в форме креатинфосфата может храниться достаточное количество фосфатных групп, полностью обеспечивающее поддержание постоянного уровня АТР в короткие периоды усиленной мышечной активности. Креатин необходим для образования в мышцах высокоэнергетического соединения креатинфосфата. Синтех креатина идет в 2 стадии с участием 3 АК – аргинина, глицина, метионина. Начинается в почках, аргинин взаимодействует с глицином с образованием орнитина и гуанидинацетата, ф-т глицинамидинотрасфераза. Образовавшийся гуанидинацетат поступает в печень, где под влиянием гуанидинацетатметилтрансферазы происходит его метилирование с образованием креатина. Источником метильной группы является метионин.Образовавшийся креатин с кровью поступает в мышцы и клетки мозга, где из него образуется креатинфосфат. Ф-т креатинкиназа. КФ обеспечивает энергией работающей мышце в начальный период. В результате неферментативногног дефосфорилирования креатинфосфат превращается в креатинин, который выводится с мочой. При заболеваниях почек параллельно с нарушением выделения клубочками других азотистых продуктов обмена нарушается выделение креатинина и наступает задержка его в крови. Креатининемия (гиперкреатининемия) – это повышение уровня креатинина в крови. Увеличение уровня креатинина в сыворотке (плазме) крови обусловлено как усиленным образованием (продукцией), так и задержкой (ретенцией) этого метаболита в организме. Продукционная креатининемия (гиперкреатининемия) – отмечается при кишечной непроходимости, острой жёлтой атрофии печени, хлоропривной азотемии (т.е. гиперазотемии вследствие уменьшения содержания осмотически активных ионов хлора), декомпенсации сердечно-сосудистой системы, пневмонии, лихорадочных состояния, мышечной дистрофии. Возрастание содержания креатинина в сыворотке (плазме) крови может быть вызвано изменением эндокринного баланса: при сахарном диабете, гипертиреозе, гипофункции надпочечников, акромегалии и гигантизме. Ретенционная креатининемия (гиперкреатининемия) – обусловлена нарушением (острым и хроническим) функции почек любого происхождения и обычно наблюдается при уменьшении клубочковой фильтрации, поражении воспалительным процессом паренхимы почек, обтурации мочевых путей ниже уровня почек. Креатининемия является как ранним показателем развивающейся недостаточности почек. Устойчивое повышение уровня креатинина в крови, как и возрастание концентрации в ней, указывает на нарушение функции почечного фильтра. Снижение уровня креатинина в сыворотке (плазме) крови (гипокреатининемия) коррелирует с уменьшением мышечной массы (мышечные дистрофии и атрофии, параличи, парезы и др.), оно наблюдается при беременности, достигая наибольшей выраженности в первом и втором триместре. В моче помимо эндогенного креатинина содержится экзогенный, поступающий в организм с мясной пищей. Поэтому уровень экскреции креатинина с мочой несколько зависит от характера питания. Увеличение выведения креатинина с мочой отмечается при большой физической нагрузке (мышечной работе), лихорадочных состояниях, острых инфекционных заболеваниях (при которых происходит усиления цитолиза, т.е. повышение распада белков клеток), пневмонии, выраженной недостаточности функции печени. Увеличение секреции креатинина с мочой происходит при ряде эндокринных расстройств (акромегалии, гигантизме, сахарном диабете). Уменьшение выведения креатинина с мочой наблюдается при голодании, длительном обездвижении больных (мышечная дистрофия), параличах, анемии, лейкозах, гипертиреозе, хронических заболеваниях почек, амилоидозе почек, голодании. Параллельное определение концентрации креатинина в крови и моче значительно расширяет диагностические возможности оценки функционального состояния почек, поскольку позволяет получить информацию об интенсивности основных функций нефрона: фильтрации, реабсорбции, секреции, а также почечного кровообращения. Концентрация креатинина зависит от общего объема мышечной ткани, поэтому содержание этого вещества в крови у мужчин больше, чем у женщин. У детей этот показатель будет намного ниже, чем у взрослых. Во время беременности, особенно во втором и третьем триместре, концентрация креатинина в плазме крови снижается. Это связано с физиологическими причинами: увеличением общего объема крови и повышением фильтрации плазмы в почках. Показатели креатинина в крови у здоровых людей: · У женщин — от 53 до 97 мкмоль/л (микромоль на один литр плазмы); · У мужчин — от 55 до 115 мкмоль/л; · У детей в возрасте до года — от 18 до 35 мкмоль/л; · У детей в возрасте от года до четырнадцати лет — от 27 до 62 мкмоль/л.
Биосинтез и распад пуриновых нуклеотидов. Исходные субстраты синтеза. Регуляция синтеза. Конечный продукт распада пуринов в организме. Роль продуктов распада пуринов в инициации перекисных процессов. Рибонуклеозид- и дезоксирибонуклеозидфосфаты - существеннейшие компоненты клеток. • Нуклеозидтрифосфаты (НТФ) используются в качестве субстратов синтеза ДНК и РНК, без которых невозможны образование белков и клеточная пролиферация. • Природа выбрала цикл АДФ-АТФ в качестве универсального механизма трансформации энергии окисления в энергию биосинтетических процессов. В некоторых биологических процессах и другие НТФ используются в качестве источника энергии. • Производные нуклеотидов служат донорами активных субстратов в синтезе гомо- и гетерополисахаридов, липидов и белков. Например: УДФ-глюкоза, УДФ-галактоза, ГДФ-манноза, УДФ-N-ацетилглюкозамин или ЦМФ-ацетилнейраминовая кислота принимают участие в синтезе гликогена и гликозаминогликанов; ЦДФ-холин - в синтезе фосфолипидов. • УДФ-глюкуроновая кислота, ФАФС, S-аде-нозилметионин - наиболее частые участники универсальной системы детоксикации, обеспечивающей последующее выведение ксенобиотиков (чужеродных веществ) и некоторых собственных метаболитов из организма. • АМФ входит в состав коферментов дегидрогеназ (NAD+, NADP+, FAD) и ацилирования (KoA). • С помощью циклических форм нуклеотидов (цAMФ, цГМФ) осуществляется передача в клетку сигналов гормонов, факторов роста, нейромедиаторов и некоторых других регуляторных молекул. Практически все клетки организма способны к синтезу нуклеотидов (исключение составляют некоторые клетки крови). Другим источником этих молекул могут быть нуклеиновые кислоты собственных тканей и пищи, однако эти источники имеют лишь второстепенное, вспомогательное значение. Первая специфическая реакция образования пуриновых нуклеотидов - перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1-амина (рис.). Эту реакцию катализирует фермент амидофосфорибозилтрансфераза. При этом формируется β-Ν-гликозидная связь. Затем к аминогруппе 5-фосфорибозил-1-амина присоединяются остаток глицина, N5, N10-мете-нил-Н4-фолата ещё одна амидная группа глута-мина, диоксид углерода, аминогруппа аспартата и формильный остаток N10-формил Н4-фолата. Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ), на синтез которого затрачивается не менее шести молекул АТФ. В отличие от прокариотов, у которых каждую стадию этого процесса катализирует отдельный фермент, у эукариотов за счёт слияния генов возникли полифункциональные ферменты, каждый из которых катализирует несколько реакций Аденинфосфорибозилтрансфераза, ответственная за образование АМФ Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая образование ИМФ и ГМФ из гипоксантина и гуанина соответственно Однако в организме при любых ситуациях этот путь синтеза пуриновых нуклеотидов, получивший название «путь спасения», имеет вспомогательное значение.
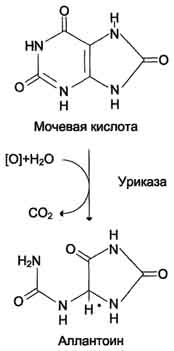
38. Нарушения обмена пуринов. Образование мочевой кислоты. Значение опреде-ления содержания мочевой кислоты в крови и в моче в клинической практике. "Нормальные величины" мочевой кислоты в крови мужчин и женщин. Гиперури-кемия. Ураты значительно более растворимы, чем мочевая кислота: так, в моче с рН 5,0, когда
мочевая кислота не диссоциирована, ее растворимость в 10 раз меньше, чем в моче с рН 7,0, при котором основная часть мочевой кислоты представлена солями. Реакция мочи зависит от состава пищи, но, как правило, она слабокислая, поэтому большинство камней в мочевыводящей системе - кристаллы мочевой кислоты. Мочевая кислота производится в человеческом организме в результате переваривания определенных продуктов, которые богаты белком и физиологически не предназначены для жизнедеятельности человека. Эти продукты используются в пищу в силу привычек, которые укоренились в результате социальных катаклизмов (революции, войны, стихийные бедствия). Речь идет о мясе, яйцах, икре рыб, рыбе. Рекомендуется есть эти продукты, во-первых, в небольшом количестве, во-вторых, раздельно друг от друга (или рыба, или мясо), а в-третьих, обязательно в сочетании со свежими и, главное, сырыми овощами, которых должно быть приблизительно в три раза больше. Именно это создаст нормальное кислотно-щелочное равновесие в человеческом организме. Однако не стоит забывать о том, что еще более токсичными, по сравнению с мясом, рыбой, яйцами, икрой рыб, считаются следующие продукты питания, которые некоторым людям могут показаться абсолютно безвредными: это кофе, чай (не цветочный), шоколад и какао. Не забывайте о том, что каждый из этих продуктов представляет собой стимулятор, подстегивающий нервную систему. Дополнительно они еще включают опасное вещество, которое называется ксантин – именно он превращается в человеческом организме в мочевую кислоту. Если Вы по-прежнему задумываетесь о необходимости отказа от этих продуктов, то учтите и ещё один факт - ксантин способствует развитию некоторых хронических заболеваний: мигрени, астмы, подагры, заболевания почек, крови, кожи, ревматизма, запоров или артритов. Каждое из перечисленных заболеваний грозит человеку, который легкомысленно не считает необходимым отказаться от шоколада и кофе и прочих любимых блюд. Если Вы периодически употребляете кофе, для того чтобы уменьшить головную боль или чтобы оказать определенное воздействие на функционирование собственного желудка, то это только ухудшит Ваше положение и, хотя, возможно, Вы и получаете сиюминутный, временный эффект – Вы подвергаете свой организм огромной опасности, связанной с повышенным содержанием в крови мочевой кислоты. Помимо того, уровень этой кислоты в крови увеличивается в результате значительных физических нагрузок, употребления алкоголя и чрезмерно продолжительного голодания. Увеличение содержания мочевой кислоты также может наблюдаться у людей, чья пища богата углеводами и жирами.
Обмен стероидов. Представление о биосинтезе холестерина. ГМГ-редуктаза- ключевой фермент синтеза холестерина. Регуляция синтеза и активности ГМГ- редуктазы. Холестерин как предшественник желчных кислот, выведение желчных кислот и холестерина из организма. Холестерин (ХС) — стероид, характерный только для животных организмов. Источником ХС в организме являются синтетические процессы и пища. В сутки в организме синтезируется около 1г (0.7) ХС. В печени синтезируется более 50% ХС, в тонком кишечнике — 15— 20%, остальной ХС синтезируется в коже, коре надпочечников, половых железах. С пищей поступает в сутки 0,3—0,5г (0.3-0.4) ХС. Общее содержание ХС в организме составляет в среднем 140г, 90-93% находиться в клетках, 7-10% - в крови (5,2 + 1,3 ммоль/л). Синтез ХС Реакции синтеза ХС происходят в цитозоле и ЭПР клеток. Это один из самых длинных метаболических путей в организме человека (около 100 последовательных реакций). Синтез ХС делят на 3 этапа: I этап синтеза ХС - образование мевалоната (мевалоновой кислоты). 1. Две молекулы ацетил-КоА конденсируются тиолазой с образованием ацетоацетил-КоА; 2. Гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток к ацетоацетил-КоА с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза КТ. Однако синтез КТ происходит в митохондриях печени, а реакции синтеза ХС — в цитозоле клеток. 3. ГМГ-КоА-редуктаза восстанавливает ГМГ-КоА до мевалоната с использованием 2 молекул НАДФH2. Фермент ГМГ-КоА-редуктаза — гликопротеин, пронизывающий мембрану ЭПР, активный центр которого выступает в цитозоль. II этап синтеза ХС - образование сквалена 1. Мевалонат превращается в изопреноидную структуру — изопентенилпирофосфат (5 атомов С); 2. 2 изопентенилпирофосфата конденсируются в геранилпирофосфат (10 атомов С); 3. Присоединение изопентенилпирофосфата к геранилпирофосфату дает фарнезилпирофосфат (15 атомов С). 4. 2 фарнезилпирофосфата конденсируются в сквален (15 атомов С). III этап синтеза ХС - образование ХС Сквален циклазой превращается в ланостерол, (4 цикла и 30 атомов С). Далее происходит 20 последовательных реакций, превращающих ланостерол в ХС (27 атомов С). В организме человека изопентенилпирофосфат также служит предшественником убихинона (KoQ) и долихола, участвующего в синтезе гликопротеинов. Регуляция синтеза ХС Ключевой фермент синтеза ХС ГМГ-КоА-редуктаза регулируется несколькими способами: · ХС, желчные кислоты (в печени) репрессируют ген ГМГ-КоА-редуктазы. В норме поступление ХС с пищей снижает синтез собственного ХС в печени, однако с возрастом эффективность этой регуляции у многих людей снижается и уровень ХС повышается. · Инсулин через дефосфорилирование осуществляет активацию ГМГ-КоА-редуктазы. · Глюкагон через фосфорилирование осуществляет ингибирование ГМГ-КоА-редуктазы. Повышение концентрации исходного субстрата ацетил-КоА стимулирует синтез ХС. Таким образом, синтез ХС активируется при питании углеводами и ингибируется при голодании. Этерификация ХС ХС образует с ЖК сложные эфиры (ЭХС), которые более гидрофобны чем сам ХС. В клетках эту реакцию катализирует АХАТ (ацилКоА: холестеролацилтрансферазой): ХС + АцилКоА → ЭХС + HSKoA АХАТ содержится лишь в некоторых тканях, синтезированный им ЭХС формирует в цитоплазме липидные капли, которые являются формой хранения ХС. По мере необходимости ЭХС гидролизуются холестеролэстеразой на ХС и ЖК. ЭХС синтезируются также в крови в ЛПВП под действием ЛХАТ (лецетин: холестеролацилтрансферазой): ХС + лецитин → ЭХС + лизолецитин В составе ЛП ЭХС обеспечивают большую часть транспорта ХС в крови. На долю ЭХС крови приходиться 75% от общего количества ЭХС в организме. Выведение ХС из организма Так как производные циклопентанпергидрофенантрена (стероиды) водонерастворимы и в организме не расщепляются, они выводятся из организма в основном с калом в составе желчи и немного с потом через кожу. В сутки из
|
|||
|
Последнее изменение этой страницы: 2017-01-27; просмотров: 644; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.02 с.) |