Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссеминированное внутрисосудистое свертывание кровиСодержание книги
Поиск на нашем сайте
Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) представляет собой нарушение гемостаза, в основе которого лежит распространенное свертывание крови с образованием большого количества микросгустков и агрегатов клеток крови, что приводит к нарушению микроциркуляции (вплоть до полной ее блокады) в органах и тканях, развитию выраженных дистрофических изменений. Этиология. ДВС-синдром развивается при различных ситуациях — хирургических вмешательствах, акушерской патологии, сепсисе, злокачественных опухолях, а также при некоторых терапевтических заболеваниях и состояниях — гемобластозах, острой и хронической почечной недостаточности, системных васкулитах, остром гемолизе. Патогенез. Изменение состояния свертывающих и противосвертыва-ющих систем при развитии ДВС-синдрома проходит несколько стадий. В начальной стадии (стадия гиперкоагуляции) под влиянием различных экзогенных (продукты жизнедеятельности бактерий, змеиные яды, трансфузионные средства и пр.) и эндогенных (продукты протеолиза и цитолиза, тканевый тромбопластин и пр.) факторов активируются процессы свертывания крови и агрегации тромбоцитов. Затем происходит выпадение тромбов, чему способствует также попадание в кровоток большого количества продуктов белкового распада под влиянием одновременной активизации других систем — фибринолитичес-кой, калликреин-кининовой. Множественное тромбообразование приводит к нарушению микроциркуляции и изменениям функций различных органов и систем. Активация свертывания крови вызывает истощение противосвертыва-ющих механизмов — физиологических антикоагулянтов (системы «гепарин — антитромбин III») и фибринолитической системы «плазминоген — плазмин». Множественное тромбообразование влечет за собой так называемую коагулопатию потребления (снижение содержания плазменных факторов свертывания) и тромбоцитопению, что обусловливает развитие геморрагического синдрома. В последние годы экспериментальные исследования и клинические наблюдения многих коагулологов, в частности в нашей стране З.С. Баркагана и его школы, внесли серьезные коррективы в учение о ДВС-синдроме, его патогенез и лечение. Как известно, долгое время этот процесс, сопровождающий все тяжелые катастрофические заболевания организма, долгое время объясняли афибриногенемией, а кровоточивость трактовали как фиб-ринолитическую. В связи с этим внутривенно вводили фибриноген, назначали аминокапроновую кислоту и другие ингибиторы фибринолиза, что приводит к негативным результатам — полиорганной недостаточности (почечной, печеночной, легочной и т.д.). Одновременно назначали препараты, повышающие свертываемость крови, так как считалось, что ДВС-синдром связан с реакцией антисвертывающей системы, которая якобы была первичной. Однако пусковым механизмом ДВС-синдрома является внутрисосудистое свертывание крови, которое на первых этапах блокировалось гепарином. Он хорошо действовал до введения антитромбина и тромбина; если же гепарин вводили после этого, то эффект был менее выраженным. Впоследствии выяснилось, что один гепарин при такой тяжелой патологии не действует независимо от этапов этого процесса — фазы гиперкоагуляции, которая может длиться всего 3 — 5 мин, или гипокоагуляции. Кроме того, было установлено, что при ДВС-синдроме количество фибриногена может быть нормальным, а факторов свертывания крови снижено; наблюдается снижение содержания физиологических антикоагулянтов — протеина С и протеина S, антитромбина III, инактивирующих активированные факторы свертывания. Их расход оказывается более выраженным, чем расход факторов свертывания крови. Установлено также, что в большинстве случаев острые ДВС-синдро-мы носят септический характер (даже акушерские), поскольку специальные исследования в течение 18 ч позволяли выявить бактериемию, усугубляющую тромбоцитопению и ферментопатию. К числу органов-мишеней относится кишечник (при ожоговой болезни, краш-синдроме и др.). Инфекционный процесс сопровождается повреждением эндотелия, увеличивается количество тромбомодулина, связывающего и инактивирующего тромбин. Тромбомодулин вместе с инакти-вированным тромбином активирует противосвертывающие вещества — протеин С, таким образом меняя свои свойства и становясь стимуляторами противосвертывающей активности. При развитии бактериемии отмечается неглубокая тромбоцитопения — до 80109/л, однако тромбоциты функционально неактивны, «заблокированы». Клиническая картина. Проявления ДВС-синдрома включают симптомы основного заболевания, картину гемокоагуляционного шока, а также геморрагический синдром различной степени выраженности, признаки нарушения микроциркуляции в органах и системах с различной степенью выраженности их недостаточности. Принято различать острый ДВС-синдром (развитие идет в пределах суток), под острый (развивается в течение нескольких суток — недели), хронический (протекает многие недели и месяцы). В течении ДВС-синдрома условно выделяют четыре стадии: 1) гиперкоагуляция и агрегация; 2) переходная с нарастающей коагуляцией, тромбоцитопенией и разнонаправленными сдвигами в различных коагуляционных тестах; 3) гипокоа-гуляция; 4) восстановительная. Гемокоагуляционный шок развивается при быстром поступлении в кровоток большого количества тканевого тромбопластина (или других веществ с аналогичным механизмом действия). Возникает острое нарушение гемодинамики с падением артериального и центрального венозного давления. Геморрагический синдром проявляется локальными кровотечениями, петехиально-пятнистым типом геморрагии, гематомами на местах инъекций, кровотечениями из органов. Иногда вытекающая из раны или полости органа кровь не образует полноценных сгустков или вообще не свертывается. Нарушение микроциркуляции проявляется острой почечной недостаточностью, часто сопровождающейся гемолизом, а также острой печеночной или легочной недостаточностью. Сочетание поражения почек и печени называется гепаторенальным синдромом. Нарушение микроциркуляции в головном мозге проявляется головокружением, обмороком, нарушением сознания (вплоть до коматозного состояния). Диагноз ДВС-синдрома уточняется данными III этапа диагностического поиска. В начальную фазу количество тромбоцитов остается нормальным или незначительно сниженным, возрастают их адгезивные и аг-регационные свойства. Повышается содержание фибриногена, укорачивается активированное частичное тромбопластиновое время, снижается фиб-ринолитическая активность. В период выпадения тромбов и развития коа-гулопатии потребления отмечается снижение количества тромбоцитов и содержания фибриногена. При появлении геморрагии содержание тромбоцитов резко снижается, а фибринолитическая активность увеличивается. Диагностика. Распознавание ДВС-синдрома основывается на учете изменения всей клинической картины течения болезни (геморрагический синдром, нарушение микроциркуляции, недостаточность функций органов и систем) и данных лабораторных исследований. Речь, естественно, идет об остром и подостром ДВС-синдроме (хронический ДВС-синдром распознается по данным лабораторных исследований и рассматривается в настоящее время как один из возможных патогенетических механизмов тех или иных заболеваний, например хронического гломерулонефрита и пр.). Лечение. Лечение ДВС-синдрома представляет сложную задачу, учитывая быстроту развития симптомов, их тяжесть и опасность для жизни. Прогрессирующий геморрагический синдром, шок с резким падением АД, ухудшение, а иногда и полное выпадение функций различных органов требует быстрых лечебных мероприятий. Лечение ДВС-синдрома должно включать мероприятия, направленные на устранение причины его развития (борьба с инфекцией, лечение основного заболевания), борьбу с шоком, коррекцию гемостаза. • Трансфузии свежезамороженной плазмы — один из основных методов лечения острого ДВС-синдрома (гепарин добавляют для того, чтобы плазма не свернулась). Свежезамороженная плазма содер- 16-340 жит антитромбин III, плазминоген, факторы свертывания и естественные антиагреганты. Ее получают методом плазмафереза крови донора и замораживают в течение 30 — 40 мин. При этом активность антитромбина III и плазминогена возрастает на 200 %. Хранение плазмы в холодильнике или при комнатной температуре снижает ее активность на 20 —40 % в сутки. Оттаивание свежезамороженной плазмы осуществляют при температуре не выше 25 °С; вводят внутривенно, струйно. В настоящее время используют супернатантную плазму, имеющую меньшую тенденцию к свертыванию, когда ее вводят больному с тромбинемией, так как в ней содержится меньше фибриногена, фактора VIII, фибронектина и фактора Виллебранда. Таким образом, появилась возможность замещения естественных физиологических антикоагулянтов. Плазмаферез и плазмозамену, позволяющие удалять активность свертывания и продукты паракоагуляции, широко используют при иммунокомплексном синдроме, тканевом распаде, некрозе, выраженном геморрагическом синдроме, септическом шоке, ожогах, при краш-синдроме, улучшают гемодинамику, предупреждают развитие острой почечной недостаточности. При выявлении бактериемии (в большинстве случаев острого ДВС-синдрома) необходимо назначать антибиотики (не очень токсичные) для стерилизации кишечника. Целесообразно вводить концентраты тромбоцитов. «Показаний к переливанию цельной крови нет, за исключением случаев, когда ге-мотрансфузия необходима по жизненным показаниям, а в учреждении отсутствует эритроцитная масса» (Инструкция по переливанию крови, 1988 г.). Трансфузии эритроцитной массы осуществляют в редких случаях — лишь при острой кровопотере (более 1 л крови), так как в крови донора содержится много активаторов свертывания крови. Поскольку острый ДВС-синдром — это «протеолитический взрыв, то на поздних этапах рекомендуется вводить антипротеазы в больших дозах (например, контрикал по 10 ампул), чтобы «заблокировать» протеолиз. 1 Для защиты эндотелия от бактериальных эндотоксинов используют эндотелиопротекторы (интерлейкины, цитокины, факторы некроза опухолей, медиаторы воспаления). | В настоящее время проводятся работы по получению антиэндо-токсинового гамма-глобулина, на который возлагаются большие надежды, но это — вопрос будущего. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ На вопросы 139—176 выберите один наиболее правильный ответ. 139. В основе патогенеза острого лейкоза лежат следующие факторы: А. Луче 140. Решающим лабораторным симптомом в диагнозе острого лейкоза является: 141. У больной острым лейкозом в развернутой стадии заболевания, в период 142. У больного 40 лет после перенесенного 2 мес назад респираторного забо 143. Указать основной метод лечения рецидива острого лейкоза: А. Курсовая 144. В основе патогенеза эритремии лежит: А. Пролиферация лейкоцитов и 145. Наиболее важным в развитии гемодинамических нарушений при эритре 146. Клинические проявления эритремии характеризуются всеми перечислен 147. У больного с эритремией при наличии выраженного акроцианоза, сплено- 148. Наиболее важным фактором, определяющим назначение цитостатических 149. Наиболее информативным методом для подтверждения миелопролифера 150. Наиболее частый клинический симптом хронического миелолейкоза: 151. Больная 52 лет в течение полутора лет отмечает боли в левом подреберье. 16* лоциты — 3 %, нейтрофильные метамиелоциты — 8 %, нейтрофильные палочко-ядерные — 12 %, сегментоядерные — 55 %, эозинофилы — 5 %, базофилы — 2 %, лимфоциты — 12 %, моноциты — 1 %). Предполагаемый диагноз: А. Тромбофлеби-тическая спленомегалия. Б. Абсцесс селезенки. В. Хронический миелолейкоз. Г. Цирроз печени. Д. Острый лейкоз. 152. Наиболее информативным методом для подтверждения лимфопролифера- 153. Наиболее характерный клинический симптом хронического лимфолейко- 154. Больной 62 лет болен в течение года: жалуется на слабость, увеличение 155. Наиболее информативным методом для подтверждения диагноза лимфо 156. Решающим в постановке диагноза лимфогранулематоза является: А. Вы 157. Больной 27 лет заболел остро: повысилась температура тела до 39 °С, по 158. Для диагноза железодефицитной анемии важно наличие следующего пока 159. Среди клинических симптомов железодефицитной анемии реже всего на 160. Наиболее частой причиной железодефицитной анемии являются: А. Кро- 161. У больной 40 лет с язвенной болезнью двенадцатиперстной кишки появи 162. Наиболее частой причиной В12-дефицитных анемий являются: А. Крово- 163. Диагноз В12-дефицитной анемии становится несомненным при изменении 164. У больной 62 лет, страдающей анемией Аддисона — Бирмера, резко ухуд 165. Признаками внутриклеточного гемолиза являются все перечисленные, 166. Диагноз гемолитической анемии становится несомненным при измене 167. Признаками р-талассемии являются все перечисленные показатели, 168. Больная 28 лет в прошлом отмечала слабость, периодическое появление 169. Больной 37 лет спустя 12 дней после перенесенного гриппа отметил по A. Пункция селезенки. Б. Определение продолжительности жизни эритроцитов. B. Определение осмотической стойкости эритроцитов. Г. Проба Кумбса. Д. Опреде 170. Наиболее существенным исследованием для диагноза гипопластической 171. У больного 20 лет в течение последних 2 мес отмечаются нарастающие 172. Наиболее типичная особенность течения заболевания при гемофилии: 173. Больная 35 лет в течение последних 5 лет отмечает частые носовые крово 174. Наиболее типичный характер кровоточивости при геморрагическом васку- 175. Достоверным критерием диагностики множественной миеломы является 176. Больная 37 лет в течение многих лет отмечает петехиально-пятнистые вы
СИСТЕМНЫЕ ВАСКУЛИТЫ
Узелковый периартериитп......................................................... 488 Неспецифический aopmoapmepuum (болезнь Такаясу)............ 496 Гранулемагпоз Вегенера.............................................................. 500 Геморрагический васкулитп (болезнь Шенлейна — Геноха) 505 Контрольные вопросы и задачи.......................................... 508 Системные васкулиты — группы заболеваний, в основе которых лежит генерализованное поражение сосудов с вторичным вовлечением в патологический процесс различных органов и тканей. При системном васкулите (СВ) имеется воспалительное поражение всех слоев сосудистой стенки (артерий или вен различного калибра), часто некротизи-рующего характера с развитием окклюзии сосуда, нарушением микроциркуляции и последующей ишемией органов и тканей (вплоть до развития инфарктов и некрозов). Воспалительный процесс, поражающий сосудистую стенку, развивается на фоне иммунопатологических процессов (гиперчувствительности немедленного или замедленного типа). Принято различать первичные и вторичные СВ. Первичные С В —генерализованные поражения сосудов, являющиеся самостоятельными нозологическими формами. Вторичные СВ — поражения сосудов, развивающиеся при других заболеваниях (например, при инфекционном эндокардите, группе диффузных заболеваний соединительной ткани, ревматоидном артрите и пр.). Несмотря на то что по клиническим проявлениям С В могут значительно отличаться друг от друга, имеется ряд общих черт, присущих всей группе заболеваний: 1) неясность этиологии; 2) общность патогенеза — нарушение иммунного гомеостаза с некон некроза плазмоклеточной, лимфоидной или гигантоклеточной инфильтрации); 3) хроническое течение с периодами обострения и ремиссий; 4) обострения возникают под влиянием неспецифических факторов 5) многосистемность поражения (суставы, кожа, внутренние органы), 6) лечебный эффект иммуносупрессивных препаратов (кортикосте- В данной главе будет рассмотрена клиническая картина и диагностический поиск при следующих системных васкулитах — узелковом периар-териите, неспецифическом аортоартериите, гранулематозе Вегенера, геморрагическом васкулите. УЗЕЛКОВЫЙ ПЕРИАРТЕРИИТ Узелковый периартериит (УП) — системный васкулит с преимущественным вовлечением в процесс артерий среднего и мелкого калибра. Сущность заболевания состоит в развитии деструктивно-пролифера-тивного панартериита на иммунной основе. Как исход и осложнения вас-кулита развиваются облитерации и тромбоз сосудов, аневризмы, разрывы сосудов. Это приводит к поражению внутренних органов, кровоснабжение которых осуществляется пораженными сосудами. В органах развиваются инфаркты, очаги некроза, атрофии и склероза с последующей функциональной недостаточностью. Этиология. Точные причины развития УП неизвестны, однако имеющиеся наблюдения позволяют считать, что УП может развиться после приема некоторых лекарственных веществ (сульфаниламиды, антибиотики, препараты йода, в том числе рентгеноконтрастные фурагиновые производные, анальгетики, туберкулостатики). Исключительно большое значение придается перенесенной вирусной инфекции: в крови больных УП обнаруживаются в большом количестве поверхностный антиген гепатита В (HBsAg), а также циркулирующие иммунные комплексы, имеющие в своем составе этот антиген. Известна роль и других вирусов в этиологии УП: цитомегаловирус, herpes simplex. Генетическая предрасположенность также играет определенную роль в развитии УП. Патогенез. Под воздействием различных внешних факторов на фоне генетически детерминированной измененной иммунной реактивности развивается нарушение иммунного ответа, что проявляется в образовании большого количества мелких растворимых иммунных комплексов, циркулирующих в сосудистом русле. В состав иммунного комплекса входят антиген (в частности, HBs-антиген), антитело к нему и комплемент. Иммунные комплексы активно откладываются под эндотелием сосудов. Это ведет к повышению сосудистой проницаемости, развивающейся под влиянием вазоактивных аминов, которые высвобождаются из базофилов и тучных клеток или тромбоцитов при их дегрануляции в результате активации комплемента. Отложение иммунных комплексов в стенке сосуда приводит к воспалительному процессу и развитию выраженных морфологических
изменений стенки. Важная роль придается реологическим и микроцирку-ляторным нарушениям, а также нарушениям процесса гемостаза (с появлением тенденции к гиперкоагуляции). Воспалительный процесс стенки сосуда в сочетании с нарушением микроциркуляции и микротромбозами обусловливает широкий спектр патологических изменений сосудов. В дальнейшем в патологический процесс вовлекаются внутренние органы (особенно часто почки), что делает клиническую картину весьма разнообразной. Патогенез УП представлен на схеме 27. Клиническая картина. УП заболевают преимущественно мужчины (в 2 —4 раза чаще, чем женщины) в возрасте 30 — 50 лет, болезнь может также наблюдаться у пожилых и детей. В связи со множественностью поражения различных сосудистых областей клиническая картина УП отличается выраженной полиморфностью (поражаются самые разные органы). Особенностью заболевания является несоответствие морфологических изменений органов их клиническим проявлениям: при значительных морфологических изменениях симптоматика со стороны пораженного органа или системы может полностью отсутствовать. Схематически клинические проявления УП можно представить в виде следующих синдромов: • сердечно-сосудистый: стенокардия покоя и напряжения, инфаркт • почечный: субклинические и латентные формы гломерулонефрита, • нейропатический: несимметричные множественные мононевриты, ре • легочный: гиперэозинофильная бронхиальная астма, пневмонит; • абдоминальный: абдомиалгия в сочетании с диспепсическими рас Сочетание тех или иных синдромов позволяет выделить клинические варианты УП: 1) почечно-висцеральный и почечно-невритический, протекающие по 2) астматический — заболевание начинается с бронхиальной астмы, 3) тромбангиитический протекает с поражением периферических со 4) периферический не сопровождается поражением внутренних орга 5) изолированный, или моноорганный, поражение одного органа На I этапе диагностического поиска можно получить сведения, указывающие на особенности начала болезни, остроту процесса, преимущественное поражение тех или иных органов. В анамнезе больных УП можно отметить острый гепатит с желтухой, контакт с больным вирусным гепатитом, переливание крови, а также появление первых симптомов болезни после приема указанных выше лекарственных веществ. Болезни предшествуют также острые респираторные заболевания, охлаждение, инсоляция, вакцинация, психоэмоциональный стресс. Болезнь обычно развивается постепенно, острое начало отмечается чаще у больных лекарственным УП. Первыми симптомами классического УП являются лихорадка, боли в мышцах, кожные высыпания, похудание. Выраженность всех этих признаков может быть весьма различной. Лихорадка среди этих симптомов стоит на первом месте; она отличается неправильным типом, не поддается действию антибиотиков, но быстро снижается при назначении глюкокортикоидов. В дальнейшем при развитии органной симптоматики температура тела нормализуется, так что значительным упорством лихорадка отличается лишь в самом начале болезни. Похудание при УП достигает достаточно выраженной степени, что создает предпосылки для диагностических ошибок (у таких больных прежде всего предполагают онкологическое заболевание). Миалгии, а также артралгии доминируют в начале заболевания. Обычно отмечают боли в икроножных мышцах и коленных суставах. У части больных болезнь может начаться с какого-либо органного поражения, чаще всего легочного. Это проявляется в упорной бронхиальной астме, протекающей с высокой эозинофилией. Появление бронхиальной астмы подобного течения всегда подозрительно на развитие У П. В самом начале болезни и позже могут наблюдаться также абдоминальные кризы — приступы сильных болей в животе без четкой их локализации, иногда сопровождающиеся расстройством стула. При дальнейшей эволюции болезни появляются симптомы поражения других органов. Для поражения почек с гипертоническим синдромом характерны церебральные жалобы, связанные с повышением АД. При поражении сердца, хотя морфологической его основой и является коронарит, болевой синдром наблюдается нечасто. Более типи
|
||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 373; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.242.20 (0.014 с.) |

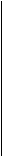 Глава VI
Глава VI Содержание
Содержание